精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
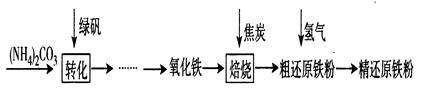
[物质制备]利用绿矾制备精还原铁粉的工艺流程如下:粗还原铁粉中还含有少量铁的氧化物和Fe
3C杂质,可用氢气在高温下进一步还原,其反应方程式为:FexOy+yH
2xFe+yH
2O Fe
3C+2H
23Fe+CH
4(1)写出焙烧中氧化铁与CO反应的化学方程式
.
(2)焙烧中加焦炭的作用除了可以生成CO外,还能
焦炭燃烧放出大量的热,产生的热量使装置内其它反应得以发生
焦炭燃烧放出大量的热,产生的热量使装置内其它反应得以发生
.
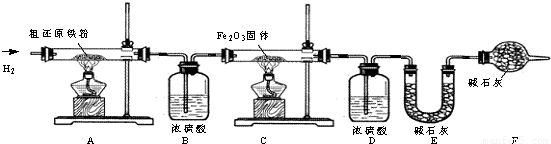
[含量测定]为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验.
已知:3CH
4+4Fe
2O
33CO
2+6H
2O+8Fe(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响).
(3)主要实验步骤如下:
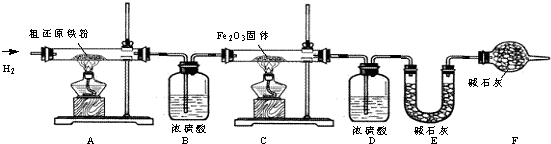
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H
2;④点燃C处酒精灯;⑤分别熄灭A、C处酒精灯;⑥再缓缓通入少量H
2;⑦再次称量必要装置的质量.操作的先后顺序是①→③→
④
④
→
②
②
→⑤→⑥→⑦(填序号)
(4)步骤③的目的是
除去装置内的氧气,防止发生爆炸
除去装置内的氧气,防止发生爆炸
,验证该步骤目的达到的实验方法是
收集尾气靠近燃着的酒精灯,听声音
收集尾气靠近燃着的酒精灯,听声音
;步骤⑥的目的是
防止生成的还原铁粉再次被氧化,起保护作用
防止生成的还原铁粉再次被氧化,起保护作用
.
(5)若装置D、E分别增重m g和n g,则m与n的关系为
C
C
(填字母);
A.11m=9n B.11m>9n C. 11m<9n
若缺少装置D,则所测氧元素的质量分数将
不变
不变
(“偏大”、“偏小”或“不变”,下同),碳元素的质量分数将
偏大
偏大
.
(6)粗还原铁粉样品的质量为10.000g,装置B、E分别增重0.180g和0.220g,则计算样品中ω
O=
1.6%
1.6%
;
ω
C=
0.6%
0.6%
.
(7)若缺少装置F,则所测氧元素的质量分数将
偏大
偏大
(“偏大”、“偏小”或“不变”,下同),碳元素的质量分数将
偏大
偏大
.

 金钥匙试卷系列答案
金钥匙试卷系列答案




 x Fe + y H2O,Fe3C + 2 H2
x Fe + y H2O,Fe3C + 2 H2 3 Fe + CH4。
3 Fe + CH4。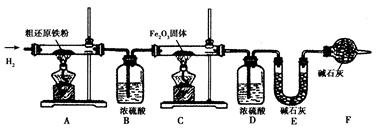
 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。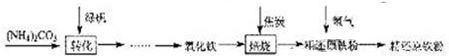
 xFe+yH2O Fe3C+2H2
xFe+yH2O Fe3C+2H2 3Fe+CH4
3Fe+CH4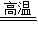 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe