
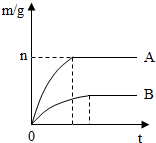
 取等质量的镁、铁两种金属,分别投入两个各装有50mL盐酸的烧杯中.反应产生氢气的质量(m)与反应时间(t)的关系如图所示.反应结束后,无固体剩余.
取等质量的镁、铁两种金属,分别投入两个各装有50mL盐酸的烧杯中.反应产生氢气的质量(m)与反应时间(t)的关系如图所示.反应结束后,无固体剩余.分析 根据金属和酸溶液反应的图象可以得出:①得到的氢气的多少②金属的活动性强弱:反应过程需要的时间越短说明该金属的活动性越强.根据氢气的质量,利用反应的方程式求出镁的质量,则得到铁的质量.
解答 解:(1)根据图象可推知,两者产生氢气不相等,故两个反应中消耗的盐酸的质量不相等;
(2)从图象中不难看出,金属A的反应需要的时间短,说明金属A的反应速率快,即金属A的金属活动性强,金属A为镁;镁与铁相比,镁的金属性比铁强且相同质量的金属完全反应镁生成的氢气比锌多;
(3)设需要镁的质量为x
Mg+HCl=MgC2l+H2↑
24 2
x 0.4g
$\frac{24}{x}=\frac{2}{0.4g}$
x=4.8g,镁、铁两种金属质量相等,铁的质量为4.8g;
答案:
(1)不相等;
(2)镁与盐酸反应的速度快;
(3)金属铁的质量是4.8g.
点评 主要考查了金属和酸溶液的反应的图象从中可以得到什么样的信息,从而培养学生分析问题、解决问题的能力,加强学生对金属活动性顺序的理解.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气变成液态氧发生化学变化 | B. | 可用带火星的木条检验氧气 | ||
| C. | 可燃物接触氧气就能燃烧 | D. | 供人体呼吸的氧气越纯越好 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 (2)三个水分子3H2O
(2)三个水分子3H2O查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 ,并写出离子符号O2-.
,并写出离子符号O2-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com