
【题目】如图中的物质为初中化学常见物质,他们之间的反应关系如图所示(“→”表示转化关系,“﹣”表示相互能反应,部分反应物、生成物或反应条件已略去)。甲是应用最广泛的金属,甲与A溶液反应得到浅绿色溶液;A、B发生中和反应,产物之一是厨房内常用的调味品;C常用于改良酸性土壤,且C的溶液与D的溶液反应可得到B;
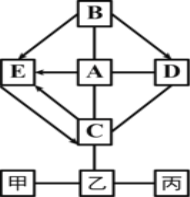
C的溶液与乙的溶液反应生成蓝色沉淀;乙与丙两种溶液反应生成两种不同颜色的沉淀。请回答:
(1)甲的化学式是 __;D的化学式是 __;其俗名是__。
(2)欲通过一步实验证明A、B是否恰好完全反应,需要向A、B反应后的溶液中加入的试剂是__。
(3)E→C反应的化学方程式是___;属于___。(填化学基本反应类型)
(4)乙与丙两种溶液反应的化学方程式是 ____ 。
【答案】 Fe Na2CO3 纯碱(苏打) 紫色石蕊试液 CaO + H2O == Ca(OH)2 化合反应 CuSO4 + Ba(OH)2 == Cu(OH)2 ↓+ BaSO4↓
【解析】甲与A反应得到浅绿色溶液,A、B发生中和反应,产物之一是厨房内常用的调味品,因此可以判断出A是盐酸,B为氢氧化钠;C常用于改良酸性土壤,因此C是氢氧化钙,C与D反应生成氢氧化钠,可判断出D为碳酸钠;C的溶液与乙的溶液反应生成蓝色沉淀,则乙是铜的盐溶液,乙与丙两种溶液反应生成两种不同颜色的沉淀,可判断出丙是氢氧化钡,乙是硫酸铜,由于甲可以和乙发生反应,因此可判断甲为铁。
解:(1)由分析可知,甲的化学式是Fe;D的化学式是Na2CO3;其俗名是纯碱(苏打);
(2)由于A是盐酸,B为氢氧化钠,欲通过一步实验证明A、B是否恰好完全反应,需要向A、B反应后的溶液中加入的试剂是:紫色石蕊试液;
(3)E→C反应的化学方程式是CaO + H2O == Ca(OH)2;属于化合反应;
(4)乙与丙两种溶液反应的化学方程式是CuSO4 + Ba(OH)2 == Cu(OH)2 ↓+ BaSO4↓。


科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质的溶解度曲线如图所示.据图回答:
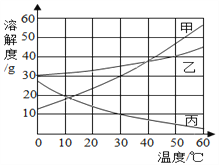
(1)30℃时,三种物质的溶解度由大到小的顺序为_____________. 要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是 ______ .
(2)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是______ ,所得溶液中溶质质量分数最小的是 ______ .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是
A. HNO3和FeCl3 B. KOH和CuSO4 C. BaCl2和Na2SO4 D. NaOH和HCl
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】电解氢氧化钠稀溶液与电解水的原理均可表示为:2H2O 通电 2H2↑+O2↑。电解一定质量氢氧化钠稀溶液的过程中,下列说法不正确的是
A. 溶液的pH减小 B. 溶液中氢元素质量分数变大
C. 溶液中钠元素质量不变 D. 溶液中氢、氧元素质量比不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将30g 碳酸钠溶液与48.2g氯化钡溶液混合,碳酸钠和氯化钡两种物质恰好完全反应。过滤,所得滤液质量为58.5g,试计算:
⑴反应后生成的沉淀质量为 克.
⑵所得滤液中溶质的质量分数为多少?(用百分数表示,写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2013年6月11日,“神舟十号”成功发射.运载“神舟十号”飞船的火箭使用偏二甲肼(C2H8N2)作燃料,下列说法正确的是( )
A.偏二甲肼由碳、氢、氮三种元素组成
B.偏二甲肼的相对分子质量为58
C.偏二甲肼中碳、氢、氮元素质量比2:8:2
D.偏二甲肼中碳元素的质量分数为50%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有关物质组成及化学规律的发现对化学的发展做出了重要贡献。
(1)法国化学家拉瓦锡为化学学科的发展做出了巨大贡献,下列有关发现与他有密切关系的是_____。
A. 空气的组成 B. 质量守恒定律 C. 水的组成 D. 酸碱指示剂
(2)在密闭容器内加入下列两种物质,并称量加入前后的总质量(含密闭容器),能验证质量守恒定律的是_____________(填标号)。
A. 蔗糖和水 B. 氯化钠溶液和硝酸钾溶液 C. 氯化钡溶液和稀硫酸
(3)在氧气中点燃红磷的实验过程,固体质量变化如图所示。
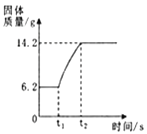
①从燃烧条件分析,固体质量在t1前没有发生变化的原因是___________。
②该反应的化学方程式为________________。
③参加反应的氧气质量为___________g。
(4)某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。
查阅资料可知Mg、Mg3N2能发生如下反应:
①2Mg+O2 △ 2MgO; ②3Mg+N2 △ Mg3N2; ③2Mg+CO2 △ 2MgO+C
④Mg+H2O △ MgO+H2↑ ⑤Mg3N2+6H2O 3Mg(OH)2↓+2NH3↑
实验中所用的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题:

①连接并检查实验装置的气密性,实验开始时,将空气通入实验装置,则气流流经装置的顺序是______(填装置序号)。D装置中发生反应的化学方程式为___________。
②通气后,如果同时点燃A、B装置的酒精灯,对实验结果有何影响?_________。
③设计一个实验,验证产物是否含氮化镁:
实验操作和实验现象 | 实验结论 |
________________________ | 产物中含有氮化镁 |
④思维拓展:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却远大于Mg3N的质量,请给出合理的解释_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D四种物质在一定条件下有如下转化关系(所有物质均已给出),则下列有关说法中,不正确的是

A. 若A、C的组成元素相同,则D是一种单质
B. 若B是酸,则C是水
C. 若B是碱,则C是水
D. A、B、C、D四种物质中可能有两种碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com