
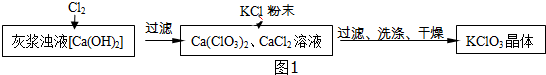
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
分析 (1)找出反应物和生成物,正确书写化学方程式;
(2)根据表格以及复分解反应的定义进行解答;
(3)根据洗涤时既要洗净又不可引入杂质进行解答;
(4)由流程图找出反应物和生成物,正确书写化学方程式,分析循环的物质.
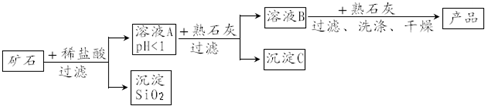
解答 解:(1)由题意可知反应物为氯气和氢氧化钙,反应物为Ca(ClO3)2、CaCl2和H2O,反应的化学方程式为:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O;
(2)由表以及复分解反应的定义,两种化合物相互交换成分可知,KCl与Ca(ClO3)2发生了复分解反应,由于KClO3在常温下溶解度较小,故可结晶析出,得到其固体;
(3)B和C都可以洗涤氯酸钾晶体,但A不可,因为它会引入新的杂质.
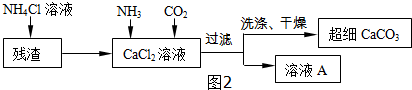
(4)由流程图可以看出,反应物为氨气和二氧化碳和氯化钙和水,生成物为碳酸钙和氯化铵,其反应的化学方程式为:CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl;因此A溶液的化学式为:NH4Cl;
故答案为:(1)6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O;(2)Ca(ClO3)2;相同温度下,氯酸钾的溶解度小;(3)BC;(4)NH4Cl.
点评 本题属于信息题的考查,综合考察了产物的判断、化学方程式的书写,锻炼了学生的逻辑思维和分析解决问题的能力.


科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 4.2 | 8.6 |
| 完全沉淀的pH | 3.2 | 6.7 | 11.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中.其中,行星模型的提出标志着原子结构的现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子、4个中子.不能根据原子结构的行星模型得出的结论是( )
原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中.其中,行星模型的提出标志着原子结构的现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子、4个中子.不能根据原子结构的行星模型得出的结论是( )| A. | 原子始终在做无规则的运动 | |
| B. | 原子核的体积只占整个原子体积的很小部分 | |
| C. | 构成原子核的粒子之间存在一种互相吸引的力 | |
| D. | 原子呈电中性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
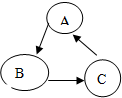 已知A、B、C是初中化学常见的物质,其转化关系如图所示:若A、B、C均含有同一种金属元素,A为红色的金属单质,B是A的氧化物,C为蓝色液体,则:(填化学式)A为Cu,写出一个符合C→A转化关系的化学方程式是:Fe+CuSO4═FeSO4+Cu.此方程的反应类型属于置换反应.
已知A、B、C是初中化学常见的物质,其转化关系如图所示:若A、B、C均含有同一种金属元素,A为红色的金属单质,B是A的氧化物,C为蓝色液体,则:(填化学式)A为Cu,写出一个符合C→A转化关系的化学方程式是:Fe+CuSO4═FeSO4+Cu.此方程的反应类型属于置换反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com