
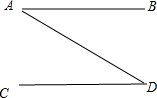
 如图所示,A、B、C、D分别为下列物质中的某一种:二氧化碳、火碱、熟石灰和硫酸铜,图中直线相连的两种物质或其溶液能相互发生反应.
如图所示,A、B、C、D分别为下列物质中的某一种:二氧化碳、火碱、熟石灰和硫酸铜,图中直线相连的两种物质或其溶液能相互发生反应.

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| 实验事实 | 实验结论 | |
| A | 某物质加稀盐酸产生气泡 | 该物质中一定含有CO32-或HCO3- |
| B | 某反应生成了盐和水 | 该反应不一定是中和反应 |
| C | 某盐溶液加足量氯化钡溶液和稀硝酸产生白色沉淀 | 该溶液一定是硫酸盐 |
| D | 某气体不能使带火星的木条复燃 | 该气体一定不含氧气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:
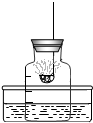 在“空气中氧气含量的测定”实验探究中,小明设计了如图所示实验装置,集气瓶下端为开口(即没有瓶底),上端瓶口有一带有燃烧匙的橡皮塞,瓶上带有刻度线,把集气瓶离水面的位置与橡皮塞之间的容积分成五等份.实验时把点燃的红磷立即插入集气瓶内,塞紧橡皮塞.回答下列问题:
在“空气中氧气含量的测定”实验探究中,小明设计了如图所示实验装置,集气瓶下端为开口(即没有瓶底),上端瓶口有一带有燃烧匙的橡皮塞,瓶上带有刻度线,把集气瓶离水面的位置与橡皮塞之间的容积分成五等份.实验时把点燃的红磷立即插入集气瓶内,塞紧橡皮塞.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 实验操作 | 实验现象 | 实验结论 |
| Ⅰ.取少量黑色产物加入到装有足量FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤. | 黑色固体部分溶解. | 猜想2和4都不成立. |
| Ⅱ. | 黑色固体全部溶解,溶液不变红色. | |
| Ⅲ.另取少量黑色产物装入玻璃管中,通入CO,一段时间后加热,并将反应后的气体通入装有一定量的 | | 猜想1不成立, 猜想3成立. |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
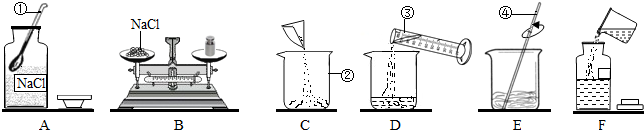
查看答案和解析>>
科目:初中化学 来源: 题型:
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
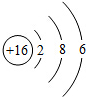 R元素的原子结构示意图如图所示,其原子的最外层电子数
R元素的原子结构示意图如图所示,其原子的最外层电子数查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com