【答案】
分析:本题是一道综合型实验题,考查的内容较多,主要有实验室氧气的原理、二氧化碳的制法和性质,并由实验现象引申出一个探究,在此又考查学生猜想和实验验证的能力.解题时既要针对题目的要求,又要联系所学习的知识,经过合理分析、推导后再回答.
解答:解:(1)甲装置适合于用固体在加热条件产生气体,若用此装置制氧气,所用的原料可用氯酸钾和二氧化锰的混合物或高锰酸钾,若用高锰酸钾,在加热时分解为锰酸钾、二氧化锰和氧气,可用化学方程式表示为:2KMnO
4?K
2MnO
4+MnO
2+O
2↑;
高锰酸钾反应后剩余的固体含有锰酸钾和二氧化锰,经过加水溶解、过滤后得到的黑色固体是二氧化锰,当其加入过氧化氢溶液时,又可作催化剂,使过氧化氢较快地放出氧气,化学方程式为:2H
2O
2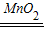
2H
2O+O
2↑;
(2)石灰水的主要成分是氢氧化钙,通入二氧化碳后,生成碳酸钙和水,碳酸钙是难溶于水的白色固体,所以可看到试管里有白色沉淀,其反应的化学方程式为:CO
2+Ca(OH)
2=CaCO
3↓+H
2O;
实验与结论
实验Ⅰ:要验证猜想①溶液呈酸性,可用石蕊试剂或PH试纸测定,由实验现象知H=8,可以推知实验操作是用PH试纸,其操作过程是用玻璃棒蘸取待测液涂在PH试纸上,待充分变色后,和标准比色卡比较,即可得出溶液的PH值,PH=8,说明溶液呈碱性,故假设①不成立;
实验Ⅱ:要验证猜想②,由题中“碳酸氢钙[Ca(HCO
3)
2]溶于水”可以推测是碳酸钙生成了碳酸氢钙,其中含有碳酸根,就可用稀盐酸来检验,如果加入稀盐酸,将会有二氧化碳气体放出,故可写出化学方程式为:2HCl+Ca(HCO
3)
2=CaCl
2+2H
2O+2CO
2↑;
反思与交流 根据探究过程,我们可以得到许多经验:如要重视观察现象,要多提出疑问,或根据探究过程直接得出化学结论,即不溶物在一定条件下可以转化为可溶物.
故答案是:
(1)2KMnO
4?K
2MnO
4+MnO
2+O
2↑、2H
2O
2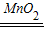
2H
2O+O
2↑;
(2)白、CO
2+Ca(OH)
2=CaCO
3↓+H
2O;
实验与结论
实验Ⅰ:用玻璃棒蘸取待测液涂在PH试纸上,待充分变色后,和标准比色卡比较,即可得出溶液的PH值、不成立;
实验Ⅱ:稀盐酸2HCl+Ca(HCO
3)
2=CaCl
2+2H
2O+2CO
2↑;
交流与反思:不溶物在一定条件下可转化为可溶物(其他合理答案亦可)
点评:本题涉及探究的考查,探究题往往具有一定的陌生度,但考查的内容还是学过的内容,只是要把它们用到新情境中,因此拿到题目不要惧怕,要将题目通读几遍,找出有用信息,在进行合理的推导或反推,最终完成问题,探究题能考查学生的思维和实验能力,是中考的重头戏,也是难点,同学们在平时除了要学好基础知识外,还要多实验,勤思考.


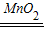 2H2O+O2↑;
2H2O+O2↑;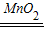 2H2O+O2↑;
2H2O+O2↑;

 考前必练系列答案
考前必练系列答案
