
 某班化学实验课进行酸碱盐的性质实验.
某班化学实验课进行酸碱盐的性质实验.| NaOH溶液 | 稀盐酸 | |
| 紫包菜汁液 | ①绿色 | ②红色 |
| 白菜汁液 | ③无色 | ④淡黄色 |
分析 根据物质的性质进行分析,适合做酸碱指示剂的物质应该在酸性和碱性溶液中显示不同的颜色,酸碱盐的溶液间若能两两交换成分生成水、气体或是沉淀,则反应能够进行,据此解答即可.
解答 解:
(2)紫包菜汁在酸性和碱性溶液中的颜色明显不同,比白菜汁更适合做酸碱指示剂,故填:紫包菜汁液;
(3)紫包菜汁液在稀盐酸中为红色,说明酸性溶液能使紫包菜汁液变红,在苹果汁中显示红色,故能说明苹果汁呈酸性,故填:酸;
【酸碱盐的性质】硫酸铜能与氢氧化钠反应生成氢氧化铜蓝色沉淀,故会观察到有蓝色絮状沉淀生成,溶液颜色变浅,该反应的化学方程式为:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓;
氯化钡能与碳酸钠反应生成碳酸钡白色沉淀和氯化钠,故填:BaCl2+Na2CO3═BaCO3↓+2NaCl;
【做出猜想】滤液中一定含有NaCl,还可能含有BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种.
【实验探究
(2)稀硫酸能与氯化钡反应生成硫酸钡沉淀,能与碳酸钠反应生成二氧化碳,故含有氯化钡或是碳酸钠的猜想均不正确,溶液变成红色,说明含有NaOH;
(3)溶液呈碱性,且加入一种试剂能产生白色沉淀,则可能是加入了氯化钡溶液,与硫酸钠反应生成了硫酸钡沉淀,故填:另取少量滤液于试管中,滴加BaCl2溶液;
【实验结论】该无色滤液的组成为 Na2SO4、NaOH、NaCl.
答案:
(2)紫包菜汁液;
(3)酸;
【酸碱盐的性质】有蓝色絮状沉淀生成,溶液颜色变浅; CuSO4+2NaOH=Na2SO4+Cu(OH)2↓;
BaCl2+Na2CO3=BaCO3↓+2NaCl
【做出猜想】NaCl;
【实验探究】 (2)Na2CO3、BaCl2; NaOH
(3)另取少量滤液于试管中,滴加BaCl2溶液;
【实验结论】NaCl、NaOH、Na2SO4
点评 本题考查了酸碱指示剂的使用以及酸碱盐物质的判别及其有关的反应,完成此题,可以依据已有的知识进行.要求同学们熟练掌握常见物质的性质以及反应时的有关现象,以便灵活应用.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:初中化学 来源: 题型:解答题
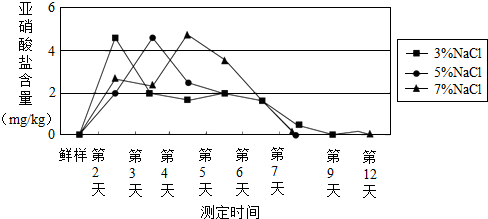
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素是一种氧化物 | |
| B. | 青蒿素的相对分子质量为280 | |
| C. | 青蒿素中C、H、0三种元素的质量比为90:11:40 | |
| D. | 青蒿素是由l5个碳原子、22个氢原子和5个氧原子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
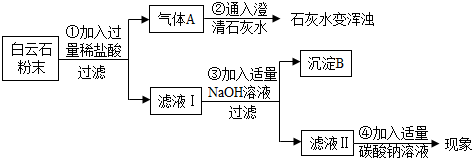
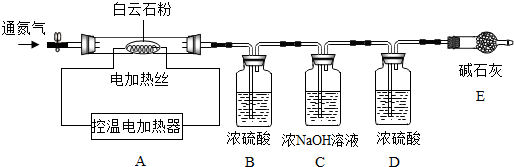
| B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | |
| 反应前 | 50.0 | 100.0 | 50.0 |
| 700℃ | 50.0 | 102.1 | 50.1 |
| 1000℃ | 50.0 | 106.3 | 50.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 柠檬酸是由碳、氢、氧三种元素组成的 | |
| B. | 柠檬酸的相对分子质量为192 | |
| C. | 一个柠檬酸分子中含有6个碳原子、8个氢原子和7个氧原子 | |
| D. | 柠檬酸中,碳、氢、氧三种元素的质量比为6:8:7 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com