
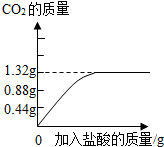
将10g碳酸钙(CaCO3)粉末放入一定量的盐酸中恰好完全反应,所得溶液中溶质的质量分数为20%.试求:
(1)生成CO2的质量.
(2)反应后所得溶液的质量.
(3)参加反应的盐酸中溶质的质量分数.(计算结果保留一位小数)
科目:初中化学 来源: 题型:
| ||
| 4.4×8.8g |
| 100 |
| 4.4×8.8g |
| 100 |
| 8.8g |
| 10g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2012?玄武区二模)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
(2012?玄武区二模)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知: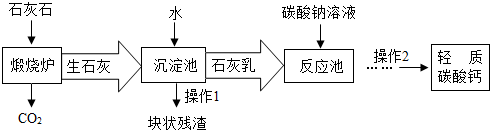
| ||
| ||
| ||
查看答案和解析>>
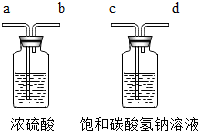
科目:初中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
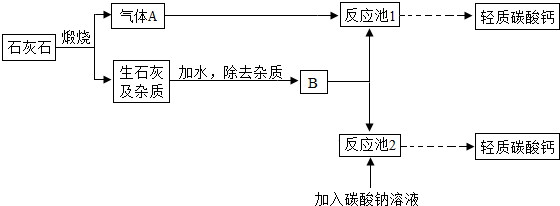
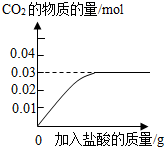
| 微热 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
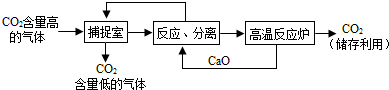
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com