
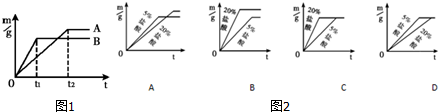
分析 (1)①可从反应速率和氢气生成量两的方面来判断,镁、锌的反应速率要比铁快,由关系式计算可知m克铁生成m/28克氢气,m克锌可生成m/32克氢气,m克镁可生成m/12克氢气,镁反应最快生成氢气最多;锌反应比铁快生成氢气最少;铁反反应最慢生成氢气量居中.
②反应物种类相同时反应物浓度高反应速率快,20%的盐酸比5%的盐酸反应速率快.
③可设计反应物相同,一个加热,一个不加热的实验来比较反应速率.
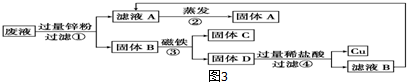
(2)CuCl2、ZnCl2、FeCl2混合物与锌粉反应生成Cu、Fe和ZnCl2溶液,经过滤磁铁吸附可把铁,铜和氯化亚铁溶液分开.
解答 解:(1)①镁、锌的反应速率要比铁快,并且由化学方程式Fe+2HCl═FeCl2+H2↑ Zn+2HCl═ZnCl2+H2↑ Mg+2HCl═MgCl2+H2↑可知m克铁生成m/28克氢气,m克锌可生成m/32克氢气,m克镁可生成m/12克氢气.图中B线反应快生成氢气少,可知对应的金属为锌;A线反应速率比锌慢可知为铁,故答案为:Zn、Zn+2HCl═ZnCl2+H2↑
②反应物种类相同时反应物浓度高反应速率快,20%的盐酸比5%的盐酸反应速率快,可排除A、D;取质量相同的锌片生成的氢气质量相同故排除B,因此答案为:C;
③可设计反应物相同,一个加热,一个不加热的实验来比较反应速率,故答案为:取两份质量相等的铁片,分别放入盛有5%的足量稀盐酸的烧杯中,将其中一只烧杯里溶液加热,观察两只烧杯中产生气泡的快慢.
(2)①CuCl2、ZnCl2、FeCl2混合物与锌粉反应生成Cu、Fe和ZnCl2溶液,经过滤,把铜、铁和锌固体与ZnCl2溶液分开,滤液A为 ZnCl2溶液,磁铁吸附可把铁和铜、锌分开,因为步骤④后生成了铜,所以D为铜和乘余的锌粉,固体C为铁,锌粉与过量稀盐酸反应生成ZnCl2溶液故答案为:ZnCl2
②通过对①的分析可知答案为:Zn+CuCl2═ZnCl2+Cu;
③如果步骤④中盐酸不过量那么仍有锌粉存在,与浅绿色的FeCl2溶液反应溶液退色,如果盐酸过量则溶液不退色.故答案为:Zn+FeCl2═Fe+ZnCl2
点评 该题通过锌、铁、镁与盐酸之间的反应考查了反应速率的知识点,并通过回收有用原料增加了学生节约药品和爱护环境的意识.


科目:初中化学 来源: 题型:选择题
| A. | 氢气用于填充气球 | B. | 镁粉用做烟花和照明弹 | ||
| C. | 用活性炭除去冰箱异味 | D. | 铜丝用做电线 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | Na2CO3 HCl H2SO4 NaNO3 | B. | K2CO3 H2SO4 HNO3 BaCl2 | ||
| C. | HCl AgNO3 HNO3 NaCl | D. | NaOH FeCl3 MgCl2 BaCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 序号 | 过氧化氢溶 液浓度/% | 过氧化氢溶 液体积/ml | 温度/ ℃ | 二氧化锰的 量/g | 收集氧气体 积/ml | 反应所需时 间/s |
| Ⅰ | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| Ⅱ | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| Ⅲ | 30 | 5 | 35 | 2 | 49.2l | |
| Ⅳ | 30 | 5 | 55 | 2 | 10.76 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 已知A、B为两种黑色粉末,A为金属氧化物,D为红色单质,A、B、C、D、E五种物质之间的转化关系如图所示.请回答:
已知A、B为两种黑色粉末,A为金属氧化物,D为红色单质,A、B、C、D、E五种物质之间的转化关系如图所示.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
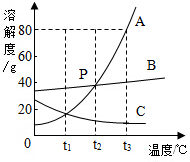 如图是A、B、C三种固体物质的溶解度曲线,回答下列问题
如图是A、B、C三种固体物质的溶解度曲线,回答下列问题查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com