
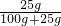 +25g×
+25g× ═66g
═66g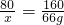
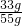 ×100%═60%
×100%═60% 2Cu+CO2↑可得炭与氧化铜反应的质量比为12:160而混合物中碳与氧化铜的质量比为22:33;可确定反应中炭过量氧化铜完全反应;故确定反应后的固体为生成的铜和过量的炭;
2Cu+CO2↑可得炭与氧化铜反应的质量比为12:160而混合物中碳与氧化铜的质量比为22:33;可确定反应中炭过量氧化铜完全反应;故确定反应后的固体为生成的铜和过量的炭; 2Cu+CO2↑
2Cu+CO2↑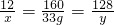
 2Cu+CO2↑可得炭与氧化铜反应的质量比为12:160而混合物中碳与氧化铜的质量比为22:33;可确定反应中炭过量氧化铜完全反应;故确定反应后的固体为生成的铜和过量的炭;
2Cu+CO2↑可得炭与氧化铜反应的质量比为12:160而混合物中碳与氧化铜的质量比为22:33;可确定反应中炭过量氧化铜完全反应;故确定反应后的固体为生成的铜和过量的炭;

 科学实验活动册系列答案
科学实验活动册系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
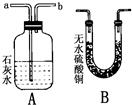 ,则猜想c成立.
,则猜想c成立.查看答案和解析>>
科目:初中化学 来源: 题型:
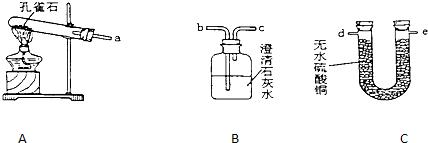
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 实验步骤 | 实验现象 | 有关化学方程式 |
| 在C中加入样品粉末W g,D中装入药品后并称量为m1 g,连接好仪器. | ||
| 打开A的上塞、活塞,慢慢滴加溶液. | ||
| 对C进行加热.当C中药品充分反应后,关 闭A的活塞,停止加热. | ||
| 冷却后,称量D的质量为m2 g. |
W-(m2-m1)×
| ||
| W |
W-(m2-m1)×
| ||
| W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com