


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:初中化学 来源: 题型:
| ①酸与指示剂作用 | 酸溶液能使紫色石蕊溶液变红色 | 酸溶液不能使无色酚酞溶液变色 |
| ②酸与活泼金属作用 | Fe+2HCl=FeCl2+H2↑ | Fe+H2SO4=FeSO4+H2↑ |
| ③酸与某些金属氧化物作用 | Fe2O3+HCl=FeCl3+H2O | … |
| ④… | ||
查看答案和解析>>
科目:初中化学 来源: 题型:
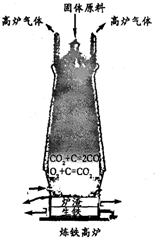 金属是一类重要的材料,人类的日常生产和生活都离不开金属.
金属是一类重要的材料,人类的日常生产和生活都离不开金属.
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2010年湖南省娄底市中考化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com