


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:初中化学 来源: 题型:阅读理解
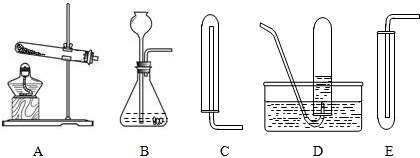
| ||
| ||
| 实验步骤 | 实验现象 | 结论 |
| a.取在空气中久置的少量固体于试管中,加足量水 | 未见固体溶解 | |
| b.向试管中滴加几滴紫色石蕊试液 | 未见明显的颜色变化 | 不存在氢氧化钙 |
| c. |
固体成分是碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
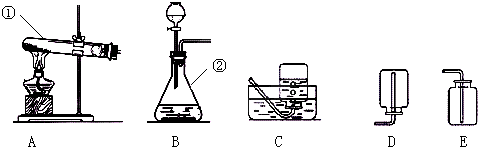
| ||
| ||
| ||
| ||
| 实验操作步骤 | 实验现象 | 实验结论 |
| ①取样品于试管中,加入适量水,充分振荡后静置并滴加几滴无色酚酞 ②或取样品于试管中,加入适量的稀盐酸 |
①试管中的液体呈红色 ② 没有气泡冒出 没有气泡冒出 |
①样品中含有: 氢氧化钙 氢氧化钙 ②样品中不含有碳酸钙. |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
学习中和反应时,老师和同学们展开了如下探究:
【探究一】:探究实验过程中的能量变化
用胶头滴管将10%的稀盐酸逐滴加入NaOH溶液中,并用温度计测量温度变化。
小文发现:随着稀盐酸的不断滴入,溶液的温度先升高后降低。对此合理的解释 ;
【探究二】:探究反应发生及反应终点问题
实验中,除了温度有变化外,没有任何现象能证明反应是否发生及反应是否已至终点,小苗在老师的帮助下,进行了下图所示的探究实验(滴加试剂时同时搅拌)。
 |
①通过实验现象,小苗排除了实验B,你认为她的理由是 ;
②实验C中溶液的颜色最终变成了红色,但也被排除,原因是 ;
③实验时,老师告诉小苗:相对于实验A,实验D也有不足。通过下面的资料,你认为理由是 ;
 【资料卡片】:
【资料卡片】:
④小波认为:将NaOH溶液和稀盐酸混合后的溶液蒸干,若得到白色固体,则说明反应生成NaCl,从而确认反应已发生,你认为这种观点是否正确,并说出理由? 。
【探究三】:探究实验过程中的意外情况
(1)为了提高实验的趣味性,老师演示了如下图所示的连贯实验,回答下列问题:

①实验1所得溶液沸腾时的温度 100℃(填“>”或“<”或“=”);
②实验后溶液一定显碱性的试管有 支,实验3后溶液中NaOH质量分数 (填“>”或“<”或“=”)实验2后溶液中NaOH质量分数;
③通过上述探究,你对酚酞试液在碱性溶液中的颜色变化有何新的认识? ;
(2)小岳在他的实验过程中意外发现有气泡出现,你认为原因是 。
【探究四】:从部分变质的NaOH样品中回收较为纯净的NaOH
小岳同学查阅了不同温度下NaOH的溶解度(见资料卡片) ,并按如下步骤进行了实验(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
,并按如下步骤进行了实验(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
【资料卡片】:

 |
①试剂A是 (填化学式)溶液;
②操作名称:Ⅰ 、Ⅱ 、Ⅲ ;
③为获得纯度较高的NaOH固体,小岳同学应在干燥前将其用 进行淋洗。
【探究五】:测定NaOH样品中NaOH的质量分数
小海取 13.5g部分变质的NaOH固体样品加适量的水配成溶液,向其中加入足量质量分数为7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设生成的CO2被完全吸收)。求:
13.5g部分变质的NaOH固体样品加适量的水配成溶液,向其中加入足量质量分数为7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设生成的CO2被完全吸收)。求:
①样品中NaOH的质量分数(精确到小数点后一位,3分);
 ②在右图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确,1分);
②在右图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确,1分);
解题过程: ;
【交流讨论】:经过讨论,大家一致认为小海方法有误,求出的NaOH的质量分数比实际值大,造成错误最有可能的原因是什么?(1分) ;
【反思提高】:欲使实验结果准确可靠,你对小海的实验会做怎样的改进?(1分) 。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
学习中和反应时,老师和同学们展开了如下探究:
【探究一】:探究实验过程中的能量变化
用胶头滴管将10%的稀盐酸逐滴加入NaOH溶液中,并用温度计测量温度变化。
小文发现:随着稀盐酸的不断滴入,溶液的温度先升高后降低。对此合理的解释 ▲ ;
【探究二】:探究反应发生及反应终点问题
实验中,除了温度有变化外,没有任何现象能证明反应是否发生及反应是否已至终点,小苗在老师的帮助下,进行了下图所示的探究实验(滴加试剂时同时搅拌)。

①通过实验现象,小苗排除了实验B,你认为她的理由是 ▲ ;
②实验C中溶液的颜色最终变成了红色,但也被排除,原因是 ▲ ;
③实验时,老师告诉小苗:相对于实验A,实验D也有不足。通过下面的资料,你认为理由是 ▲ ;
 【资料卡片】:
【资料卡片】:
④小波认为:将NaOH溶液和稀盐酸混合后的溶液蒸干,若得到白色固体,则说明反应生成NaCl,从而确认反应已发生,你认为这种观点是否正确,并说出理由? ▲ 。
【探究三】:探究实验过程中的意外情况
(1)为了提高实验的趣味性,老师演示了如下图所示的连贯实验,回答下列问题:

①实验1所得溶液沸腾时的温度 ▲ 100℃(填“>”或“<”或“=”);
②实验后溶液一定显碱性的试管有 ▲ 支,实验3后溶液中NaOH质量分数 ▲ (填“>”或“<”或“=”)实验2后溶液中NaOH质量分数;
③通过上述探究,你对酚酞试液在碱性溶液中的颜色变化有何新的认识? ▲ ;
(2)小岳在他的实验过程中意外发现有气泡出现,你认为原因是 ▲ 。
【探究四】:从部分变质的NaOH样品中回收较为纯净的NaOH
小岳同学查阅了不同温度下NaOH的溶解度(见资料卡片),并按如下步骤进行了实验(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
【资料卡片】:

 |
①试剂A是 ▲ (填化学式)溶液;
②操作名称:Ⅰ ▲ 、Ⅱ ▲ 、Ⅲ ▲ ;
③为获得纯度较高的NaOH固体,小岳同学应在干燥前将其用 ▲ 进行淋洗。
【探究五】:测定NaOH样品中NaOH的质量分数
小海取13.5g部分变质的NaOH固体样品加适量的水配成溶液,向其中加入足量质量分数为7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设生成的CO2被完全吸收)。求:
①样品中NaOH的质量分数(精确到小数点后一位,3分);
 ②在右图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确,1分);
②在右图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确,1分);
解题过程: ▲ ;
【交流讨论】:经过讨论,大家一致认为小海方法有误,求出的NaOH的质量分数比实际值大,造成错误最有可能的原因是什么?(1分) ▲ ;
【反思提高】:欲使实验结果准确可靠,你对小海的实验会做怎样的改进?(1分) ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com