
【题目】利用所学知识回答下列问题。
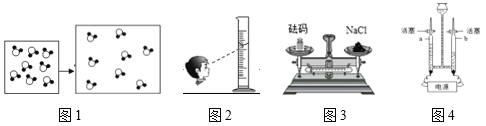
(1)图1表示的是某物质发生某变化的微观示意图,发生该变化的条件是_____(填一个)
(2)按图2方式量取了20mL水用于稀释浓硫酸,稀释后的实际浓度_____稀释后的理论浓度(填>、<或=)。
(3)按图3称量3.0g氯化钠(1g以下用游码)。实际称得的氯化钠的质量_____3.0g(填>、<或=)。
(4)图4所示的实验结束后,a管所收集到气体的质量与b管所收集到气体的质量比为_____。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,对于该图象的理解,有下列说法,其中正确的是( )
①B表示铁和稀硫酸的反应曲线
②反应结束后铁一定有剩余锌可能有剩余
③反应结束后消耗的稀硫酸质量相等
④反应结束后生成氢气的质量相等
⑤反应结束后所得溶液质量相等。
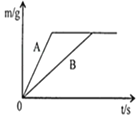
A. ①③④B. ①③⑤C. ①②③④D. ②④⑤
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知某种治疗胃病药品的主要成份是铝碳酸镁片,化学式为: AlaMgb(OH)16CO3·4H 2O,假设药品中的其它成份受热不分解、不溶于水且不与稀硫酸反应。某研究性学习小组设计了如下实验探究铝碳酸镁片的组成。查阅资料:氯化钙是一种白色粒状物, 吸水性极强,暴露于空气中极易潮解; 碱石灰是氢氧化钠和氧化钙的混合物。
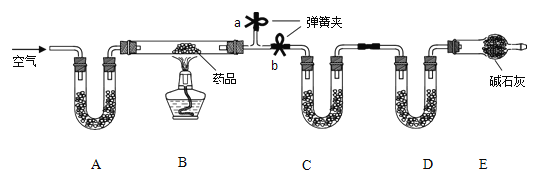
(实验一)取m g 该药片,研成粉末放入硬质玻璃管中,加热。
(1)铝碳酸镁片加热分解的产物为Al2O3、MgO、CO2 和水,若要测定生成的 CO2 和水的质量,装置 C和D 中盛放的药品应选择:C_________、D_______。(填序号)。
①浓硫酸 ②碱石灰 ③氯化钙 ④纯碱
(2)实验开始前关闭弹簧夹 b,打开 a,先通入一段时间空气,装置A 中盛放的是碱石灰,它的作用是___。
(3)一段时间后,打开和关闭相应的弹簧夹,点燃酒精灯加热,充分反应后,停止加热,继续通入一段时间空气,目的是______。
(实验二)另取m g 该药片,加入 100g 19.6%的稀硫酸,充分反应后滤去不溶物,得到含有 MgSO4 和Al2(SO4)3 等溶质的滤液,向滤液中逐渐加入足量的稀 NaOH 溶液,产生沉淀的质量与加入溶液中 NaOH 的质量的关系如图。
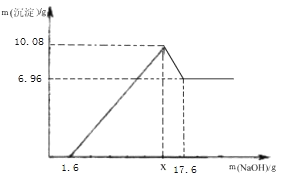
已知:Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,Al(OH)3+NaOH=NaAlO2+2H2O, NaAlO2 可溶于水。
(1)写出 MgSO4 与NaOH 的反应方程式______。
(2)图中当加入溶液中NaOH 的质量为 1.6g 时仍没有沉淀,说明滤液中含有______。当加入溶液中溶质 NaOH 的质量到 x 时,生成的沉淀是______,x=_____g。
(3)医生建议服用该药片时一定要嚼碎后再吞服,试用你所学的知识解释这样建议的理由是______。
(4)试确定铝碳酸镁的化学式为______。
(反思提升)许多重大科学发现,源自对试验中异常现象的大胆质疑,深入研究。下列科学成果是通过对异常现象研究得出的是(填序号)______。
A 侯德榜潜心研究制碱技术发明了联合制碱法
B 拉瓦锡深入研究前人忽视的异常现象发现了氧气
C 张青莲主持测定了多种元素相对原子质量的新值
D波义耳不慎将浓盐酸溅到花瓣上从而发现了酸碱指示剂
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为A、B、C三种固体物质(不含结晶水)的溶解度曲线。下列有关说法正确的是_____
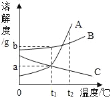
A.t1℃三种物质的饱和溶液中,溶质质量最大的是B
B.t2℃三种物质的饱和溶液中,溶质的质量分数最大的是A
C.可用降低温度的方法使t2℃时C的不饱和溶液变为饱和溶液
D.将t2℃时的三种物质的饱和溶液降温至t1℃时,溶质的质量分数由大到小的顺序是:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校兴趣小组的同学为了测定某石灰石中碳酸钙的质量分数,他们取该石灰石样品10g加入烧杯中,再把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的杂质既不溶于水,也不与稀盐酸反应):
实验次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 6 | m | 1.2 | 1.2 |
分析表中数据,完成下列问题:
(1)表中m的数值为___;
(2)计算稀盐酸的溶质质量分数____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某中学化学兴趣小组的同学查资料知道,乙醇(化学式为C2H5OH)俗称酒精,通常情况下化学性质稳定,在一定条件下能与金属氧化物反应。醋酸具有酸性,能使紫色石蕊溶液变红。无水硫酸铜固体遇水变蓝。现对乙醇与金属氧化物反应进行探究。
(探究活动一)同学们把绕成螺旋状的红色铜丝在酒精灯的外焰上灼烧到通红,取出铜丝,发现表面变黑,趁热插入装有无水乙醇的试管中(如图),铜丝很快又变回红色,并闻到刺激性气味。重复上述操作多次,得到A溶液;铜丝灼烧后生成的黑色物质的化学式是_____。

(提出问题)生成的刺激性气味的气体是什么?
(猜想与假设)有同学提出刺激性气味的气体可能是:猜想一:SO2 猜想二:CO2 猜想三:醋酸(C2H4O2)
(讨论与结论)同学们讨论后发表看法:
①小兵认为猜想一不正确,判断的依据是_____。
②小周认为猜想二也不正确,判断的依据是_____。
③小华认为猜想三有可能正确,原因是醋酸具有挥发性,并有刺激性气味。
(探究活动二)小兰同学设计实验验证后,发现猜想三也不正确。请补充完成小兰的实验操作和现象:取少量A溶液加入试管中,然后_____。同学们再取少量A溶液加入试管中,加少量无水硫酸铜固体,震荡,变蓝色(已知:乙醇遇无水硫酸铜不显蓝色)。老师告诉同学们该反应生成的刺激性气味的气体为乙醛(C2H4O)。请写出由乙醇生成乙醛的化学反应方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学完酸碱盐之后,小明头脑里一直有疑惑,为什么老师说金属活动顺序表中钾、钙、钠很活泼,却又不能把它后面金属从盐溶液中置换出来呢?带着疑问小明走进了实验室。
(查阅资料)钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑。
(实验探究)小明先取一定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,反应剧热,充分反应后过滤,得到滤液和蓝色滤渣,根据已学知识可推断蓝色滤渣为并对滤液的成分进行探究。
(猜想与假设)猜想一:Na2SO4;猜想二:Na2SO4和NaOH;猜想三_____。猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想_____不合理,理由是_____(用化学方程式表示)。
(查阅资料)Na2SO4溶液呈中性
(实验与验证)
实验 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | _____ | 猜想一不成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属确实_____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。
(继续探究)小明将4.6g钠投入到含HCl 3.65g的稀盐酸中,反应更加剧热,这是因为钠的性质很活泼,很容易失去最外层的一个电子而形成_____。请计算该过程中产生H2的质量_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。某研究性小组对K2SO4和Mn3O4的制备展开了系列研究。
Ⅰ.以硫酸工业的尾气SO2制备K2SO4的工艺流程如下:
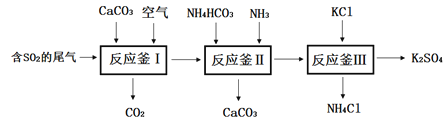
(1)反应釜I中发生的反应包括: 2CaCO3 + 2SO2+O2=2_______+2CO2
(2)反应釜III:向反应II 所得(NH4)2SO4溶液中加入KCl溶液充分反应后,经蒸发浓缩、过滤 、洗涤、干燥等操作即可制得K2SO4产品。为提高K2SO4产品纯度,过滤时应控制反应液的温度范围为______(填字母序号,如图为几种盐的溶解度曲线)。
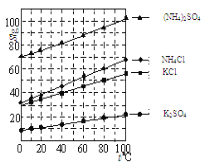
A 0℃-10℃ B 20℃-30℃ C 60℃-65℃ D 80℃-90℃
(3)上述工艺流程中循环利用的物质是_______;检验产品K2SO4中不含杂质选用的试剂是_____
A AgNO3溶液 B BaCl2溶液 C Ba(NO3)2溶液 DNaOH溶液
Ⅱ.实验室以SO2气体为原料制备少量高纯Mn3O4的操作步骤如下:
[资料1]亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
[资料2] MnSO4在空气中高温煅烧生成Mn3O4和三氧化硫,当温度超过1000℃时,Mn3O4易被氧化。
(步骤I)制备MnSO4溶液:在三颈烧瓶中(装置见(如图)加入一定量MnO2和水,先通氮气,再通入SO2和N2混合气体,搅拌反应3小时。停止通SO2,继续反应片刻后过滤得MnSO4溶液。
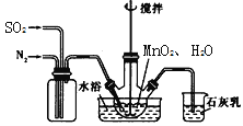
(4)烧杯中石灰乳(有效成分为氢氧化钙)的作用为____________。
(5)三颈烧瓶中生成MnSO4的反应化学方程式为______________。
(6)步骤I中,先通入氮气的目的是____________。为使SO2尽可能转化完全,在不改变固液投料和通入的SO2和N2比例一定的条件下,可采取的合理措施有:及时搅拌反应液、____________(任写1条)。
(步骤II)制备MnSO4H2O晶体:利用硫酸锰的溶解度在100℃以上随温度升高而急剧降低的原理,采用压力釜升温加压结晶法后过滤、洗涤、低温干燥得纯净的MnSO4H2O晶体。
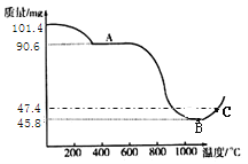
(步骤III)制备Mn3O4固体:准确称取101.4mg MnSO4H2O,将MnSO4H2O晶体在空气中高温煅烧,下图是用热重分析仪测定煅烧时温度与剩余固体质量变化曲线。
(7)Mn3O4中的Mn元素有+2,+3价,则Mn3O4中+2价和+3价锰的比例为_____
(8)该曲线中A段所表示物质的化学式为____________。
(9)试通过计算确定反应至图中C点时所对应的剩余固体成分的化学式____(请写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)化学用语是国际通用的语言,请用化学用语填空:
①氦元素______;②2个硫酸根离子______;
③甲烷______;④标出KClO3中Cl的化合价______;
(2)写出“3NO2”中数字的含义:
①“3”表示______;
②“2”表示______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com