
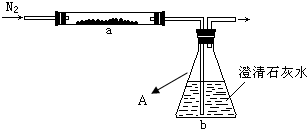
 2M+CO2↑和______(请再举一例,用化学方程式表示),请补全题干中的实验步骤______.
2M+CO2↑和______(请再举一例,用化学方程式表示),请补全题干中的实验步骤______. 2M+CO2↑,则1.8g的MO与0.12g的C充分反应,①生成的二氧化碳至少需要溶质质量发生为0.1%的澄清石灰水多少g才能完全吸收,转化为碳酸钙?(MO的相对分子质量为80)(本题2分,写出计算过程)
2M+CO2↑,则1.8g的MO与0.12g的C充分反应,①生成的二氧化碳至少需要溶质质量发生为0.1%的澄清石灰水多少g才能完全吸收,转化为碳酸钙?(MO的相对分子质量为80)(本题2分,写出计算过程) 2M+CO2↑和 MO+C
2M+CO2↑和 MO+C M+CO↑、MO+CO
M+CO↑、MO+CO M+CO2、CO2+C
M+CO2、CO2+C 2CO,为了防止生成的铜重新被氧化,待反应完全后,停止加热,还要仍继续通氮气,直至反应管冷却,
2CO,为了防止生成的铜重新被氧化,待反应完全后,停止加热,还要仍继续通氮气,直至反应管冷却, 2Cu+CO2↑
2Cu+CO2↑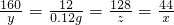
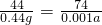
 M+CO↑ 或 MO+CO
M+CO↑ 或 MO+CO M+CO2 或 CO2+C
M+CO2 或 CO2+C 2CO;
2CO;

 小学能力测试卷系列答案
小学能力测试卷系列答案科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2011年江苏省扬州中学树人学校中考化学三模试卷(解析版) 题型:解答题
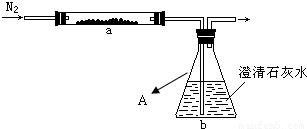
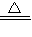 2M+CO2↑和______ M+CO↑
2M+CO2↑和______ M+CO↑查看答案和解析>>
科目:初中化学 来源:2012年江苏省扬州市宝应县城北中学中考化学冲刺试卷(3)(解析版) 题型:解答题
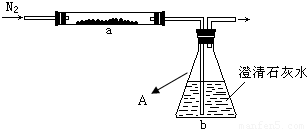
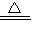 2M+CO2↑和______ M+CO↑
2M+CO2↑和______ M+CO↑查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com