
【题目】80g质量分数为40%的氢氧化钠溶液与一定质量的氯化镁溶液混合,恰好完全反应,经过滤,得到滤液的质量为216.8g。请计算:
(1)原氯化镁溶液中溶质的质量分数;
(2)所得滤液中溶质的质量分数(计算结果精确至0.1%)。
【答案】23.8%, 21.6%
【解析】本题考查了溶质质量分数与化学方程式相结合的计算。
设:氯化镁的质量为x,生成氢氧化镁的质量为y,生成氯化钠的质量为z,
MgCl2+2NaOH═Mg(OH)2↓+2NaCl,
95 80 58 117
x 80g×40% y z
![]() x=38g,
x=38g,
![]() y=23.2g,
y=23.2g,
![]() z=46.8g,
z=46.8g,
氯化镁溶液的质量为:216.8g+23.2g-80g=160g,
原氯化镁溶液中溶质的质量分数为:![]() ×100%=23.8%,
×100%=23.8%,
所得滤液中溶质的质量分数为:![]() ×100%=21.6%。
×100%=21.6%。
答:(1)原氯化镁溶液中溶质的质量分数为23.8%;
(2)所得滤液中溶质的质量分数为21.6%。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:初中化学 来源: 题型:
【题目】电动平衡车是一种新型的交通工具。如图为一款电动平衡车的示意图。

(1)所标物质中,属于有机合成材料的是___________ (填一种即可,下同),属于金属材料的是___________。
(2)合金与纯金属相比,优点是 ___________;写出能表示铝和铁的金属活动性强弱的化学方程式___________________。
(3)电动平衡车是现代人用来作为代步工具、休闲娱乐的一种新型的绿色环保的产物。由此你对化学与人类生活的关系有何感想?_________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向lOOgBaCl2溶液中逐滴滴加Na2C03溶液,生成沉淀的质量与滴入Na2C03溶液的质量关系如图所示,请计算:
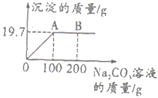
(1)生成沉淀的质量为_______________g。
(2)若在A点结束实验,过滤后所得溶液的溶质质量分数(计算结果精确到0.1%)。_________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)“对比”是一种重要的实验探究手段,通过“对比”可以判断是否发生反应,反应的速率、反应的条件等。请回答下列问题:
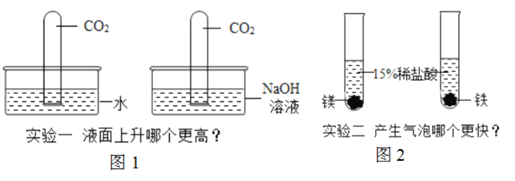
①写出实验一中液面“更高”的化学方程式:_________________________。
②根据实验二的现象从而得出活动性Mg_______Fe。
(2)实验三所示是酸碱中和反应的实验研究:
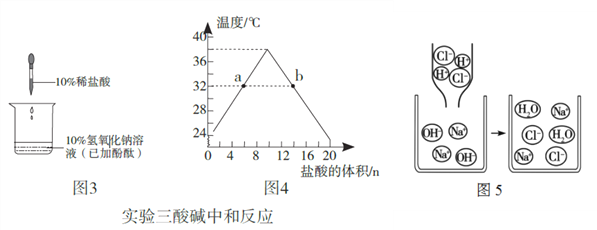
①滴加稀盐酸前,烧杯中溶液呈______色。随着稀盐酸不断滴入溶液呈无色,为探究反应后稀盐酸是否过量,可选用的试剂有_____________。(填选项,多选)
A.Ca(OH)2 B.锌粒 C.鸡蛋壳 D.紫色石蕊溶液 E.铜丝
②随着盐酸不断滴入,烧杯中溶液的pH逐渐______。(填“增大”、“减小”或“不变”)
③随着盐酸不断滴入,烧杯中溶液温度变化如坐标图4所示。根据图象可以判断中和反应是______反应(填“放热”或“吸热”)。
④图5是NaOH和稀HCl反应的示意图,用化学反应方程式表示为_____________,从该图可以看出,反应前后微粒数目减少的有_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知物质A~H为初中化学常见物质,请根据下列表述回答问题。
(1)已知A、B、C、D均含有两种元素,且物质B、D元素组成相同。固体A中加入液体B,能放出大量热。将固体C加入D的水溶液中,有气泡产生,充分反应后过滤,只得到液体B和固体C.
①A跟B反应的生成物可用于改良酸性土壤或用于建筑材料等,则A和B反应的化学方程式为_________.
②C的化学式为______________.
(2)固体E、F和物质G、H的水溶液中,任意一种固体与任意一种溶液混合均有气泡产生。E通过其他反应途径能生成F。
①若E为单质,E、F的化学式可能为______________ (写一组即可)。
②若E和F均含三种元素,E生成F的化学方程式为:_____________,固体E和二氧化硅在高温条件下可生成硅酸钠(Na2SiO3)和一种能产生温室效应的常见气体,该反应的化学方程式为:__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】课外小组的同学自制一块多槽铁板,设计了下图所示装置,用以探究燃烧的条件。(说明:金属板上白磷足量)。回答下列问题:
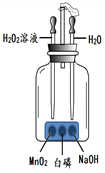
(1)推出可燃物燃烧需要一定温度的依据是__________。
(2)将过氧化氢溶液滴入盛有MnO2 的金属槽中,发生反应的化学方程式为__________。
(3)有同学提出“将NaOH换成水,然后将水换成浓硫酸,也可以完成探究活动”。你认为是否可行,为什么?_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:
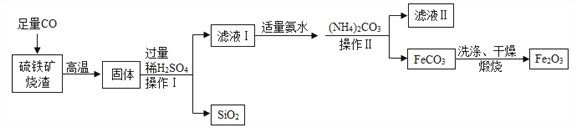
已知:(NH4)2CO3溶液呈碱性,40℃以上时(NH4)2CO3分解。
(1)高温时硫铁矿烧渣中的Fe2O3与CO发生反应的化学方程式为______________________________。
(2)实验室中,步骤1、步骤Ⅱ中实现固液分离的操作为________,用到的玻璃仪器有玻璃棒、烧杯、_____等。
(3)步骤Ⅱ中由(NH4)2CO3生成FeCO3的变化属于______________(填基本反应类型),加适量氨水的目的是___________________________________。
(4)洗涤FeCO3的目的是除去表面附着的杂质,洗涤干净的标志是“取最后一次洗涤液,加入适量的________溶液,无白色沉淀产生”。
(5)加入(NH4)2CO3后,该反应必须控制的条件是____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】食盐(NaCl)、碳酸钠(Na2CO3)、生石灰(CaO)是制作皮蛋料泥的主要原料。制作料泥时,将上述原料加入适量水中,搅拌混合均匀即可。
(1)①制作料泥时,生石灰与水反应的化学方程式是__________________。
②制作料泥时,与碳酸钠反应的物质是_____________________(写化学式)。
(2)某化学兴趣小组对影响溶液碱性强弱的因素展开探究。用不同温度的水,配制溶质质量分数分别为2%、6%和10%的碳酸钠溶液,依次测量溶液的pH,记录数据如下表:
实验编号 | a1 | a2 | a3 | b1 | b2 | b3 | c1 | c2 | c3 |
溶质质量分数 | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
水的温度(℃) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 50 | 70 |
溶液pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | X | 11.50 |
请你分析表中数据回答:
①溶液碱性最强的是___________(填实验编号)
②实验a1、b1、c1的实验目的是________________________。
③在相同的条件下,一定温度范围内,温度与碳酸钠溶液pH的关系是____________________。
④表格中X的数值可能是____________(填选项)。
A.11.20 B.11.25 C.11.37 D.11.62
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。若混合液中CuCl2的质量分数为27%,则:
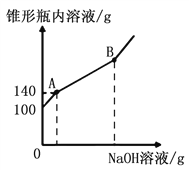
(l)完全反应后,产生了_____g沉淀。
(2)求混合液中HCl的质量分数__________。
(3)反应至B点时,锥形瓶内溶液的质量为多少克____________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com