
| 选项 | 实验目的 | 实验操作 |
| A | 除去氮气中的少量氧气 | 将气体缓缓通过炽热的铜网 |
| B | 区分硝酸铵与氢氧化钠 | 分别取样,加入适量水 |
| C | 检验氢氧化钠溶液是否变质 | 取样,滴入几滴酚酞溶液 |
| D | 提纯含有少量氯化钠的硝酸钾 | 冷却热的饱和溶液,过滤,洗涤,干燥 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据氧气会与铜反应生成氧化铜进行分析;
B、根据硝酸铵溶于水,溶液温度降低,氢氧化钠溶于水,溶液温度升高进行分析;
C、根据氢氧化钠和碳酸钠都显碱性进行分析;
D、根据硝酸钾溶解度受温度影响变化较大进行分析.
解答 解:A、混合气通过炽热的铜网,氧气和铜会生成氧化铜,剩下氮气,故A正确;
B、取样品,加水溶解,溶液温度明显降低的是硝酸铵,溶液温度明显升高的是氢氧化钠,现象不同,可以鉴别,故B正确;
C、氢氧化钠和碳酸钠都显碱性,都能使酚酞变红色,现象相同,不能鉴别,故C错误;
D、硝酸钾溶解度受温度影响变化较大,冷却热的饱和溶液,过滤,洗涤,干燥,可以提纯硝酸钾,故D正确.
故选:C.
点评 利用所要鉴别物质的性质差别,设计实验使实验中出现明显的现象差异,达到鉴别物质的目的.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
| A. | 茶氨酸属于有机高分子化合物 | |
| B. | 茶氨酸中碳元素与氢元素的质量比是6:1 | |
| C. | 茶氨酸中氧元素的质量分数最大 | |
| D. | 一个茶氨酸分子中含有一个氨分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
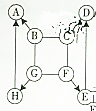 如图所示,A-H是初中化学常见的物质,图中“→”表示一种物质能转化为另一种物质,“-”表示两种物质能发生反应(部分反应物、生成物及反应条件未示出).其中A、G为常见的金属,E、H常温下为气体,E能形成温室效应,D常温下为液体,C是一种碱,在生活中可用来去除油污.请根据图填写下列空格:
如图所示,A-H是初中化学常见的物质,图中“→”表示一种物质能转化为另一种物质,“-”表示两种物质能发生反应(部分反应物、生成物及反应条件未示出).其中A、G为常见的金属,E、H常温下为气体,E能形成温室效应,D常温下为液体,C是一种碱,在生活中可用来去除油污.请根据图填写下列空格:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 进入久未开启的菜窖前,先用燃着的蜡烛进行试验 | |
| B. | 烧菜时油锅着火,立即用锅盖盖灭 | |
| C. | 用聚乙烯(PVC)塑料保鲜膜包装食品 | |
| D. | 用氢氧化钠溶液处理硫在氧气中燃烧产生的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | SiO2 | B. | C | C. | Si | D. | CO |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| R | O2 | CO2 | H2O | |
| 反应前质量(/g) | 51 | 96 | 0 | 0 |
| 反应后质量(/g) | x | 0 | 88 | 54 |
| A. | x值为5 | |
| B. | 反应生成二氧化碳和水的分子个数比为3:2 | |
| C. | R物质中碳、氢质量比为4:1 | |
| D. | R物质中不只含有碳、氢元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 常温下,过氧化氢溶液极易分解产生氧气 | |
| B. | 验满氧气的方法是用带火星的木条靠近集气瓶口 | |
| C. | 配制一定质量分数的NaCl溶液必需的玻璃仪器只有烧杯和玻棒 | |
| D. | 露置在空气中的氢氧化钠,其成分不会发生变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 丙 甲 乙 | B. | 甲 丙 乙 | C. | 乙 甲 丙 | D. | 丙 乙 甲 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
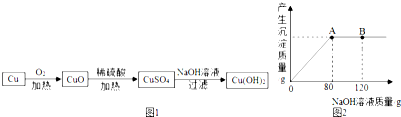
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com