(2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
【提出问题】
1.金属钠能否置换出硫酸铜溶液中的铜?
2.金属钠能否在其他气体(如:CO
2)中燃烧?
【查阅资料】金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠.金属钠还可以与水剧烈反应放出氢气.
【实验探究】
实验一:
①在实验室中,金属钠保存在煤油中;
②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红.
实验二:将燃烧的钠迅速伸入盛有CO
2的集气瓶中,观察到钠在CO
2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质.
【问题讨论】
(1)金属钠保存在煤油中的原因是:
防止钠与氧气和水反应变质
防止钠与氧气和水反应变质
.
(2)根据上述资料写出钠块投入水中发生反应的化学方程式:
2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
.
(3)实验二中生成的黑色颗粒是
碳
碳
,而白色物质可能是什么呢?
①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是氧化钠,乙认为是碳酸钠,丙认为是氧化钠和碳酸钠的混合物,丁认为是氢氧化钠.我认为丁的猜想是错误的,理由是
反应物中没有氢元素
反应物中没有氢元素
.
②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有氧化钠.
方案2:取该样品少量于试管里,滴加足量盐酸,溶液中有气泡冒出,结论:白色物质中一定有
碳酸钠
碳酸钠
.
方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的
B
B
溶液(供选试剂:A.石灰水B.氯化钙溶液 C.硫酸铜溶液),出现白色沉淀,然后过滤,再向溶液里滴加无色酚酞试液,无明显现象出现.则
乙
乙
(在甲、乙、丙中选)的猜想成立.
③评价与反思:小娟同学认为实验方案1得出的结论不正确,其理由是
碳酸钠溶液也是碱性的
碳酸钠溶液也是碱性的
;
实验室中的金属钠着火时,你的灭火方法是
用沙子覆盖
用沙子覆盖
.
【拓展应用】
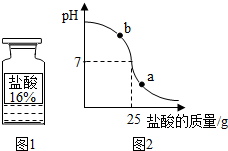
测定实验中使用的标有质量分数为16%的盐酸(图1)的实际质量分数.
(1)为了测定,需配制20%的氢氧化钠溶液100g.配制步骤有:①溶解 ②计算,需氢氧化钠
20
20
g ③装瓶并贴标签 ④称取氢氧化钠,量取水
80
80
mL(水的密度为1g/mL).其正确的顺序为
②④①③
②④①③
(填序号).
配制氢氧化钠溶液时,需要的玻璃仪器有量筒、烧杯、滴管及
玻璃棒
玻璃棒
.
(2)小明同学在烧杯中加入配得的氢氧化钠溶液20g,再逐滴加入该盐酸.用pH测定仪测定滴加过程中溶液的pH.图2为测定仪打印出的滴加盐酸的质量与溶液pH的关系图.
①a点对应的溶液呈
酸性
酸性
(填“酸性”、“碱性”或“中性”);
b点对应的溶液中的溶质为
NaCl、NaOH
NaCl、NaOH
(写化学式).
②请以此次测定的数据,列式计算该盐酸的实际质量分数?
(3)该盐酸的实际质量分数与标签上标出的质量分数不一致的可能原因
盐酸具有挥发性
盐酸具有挥发性
(不考虑误差).



 (2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
(2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题: