
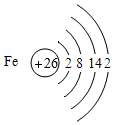
 铁及其化合物是中学化学学习和研究的重要内容.
铁及其化合物是中学化学学习和研究的重要内容.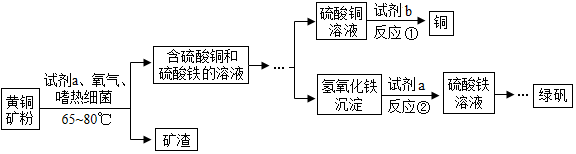
分析 (1 )根据给出的铁的原子结构示意图以及地壳中含量进行分析;
(2)结合给出的信息进行化学方程式的书写,明确反应物和生成物进而进行化学方程式的书写和配平;
(3)熟记铁丝燃烧实验 中的注意事项,结合实际需要选择金属防锈的具体方法;
(4)结合实验设计原理进行问题的分析和解答,注意结合流程进行化学方程式的书写以及计算.
解答 解:(1 )A.铁元素是金字旁,为金属元素;
B.由图核内数字为26可知,铁原子的质子数为26;
C.铁原子最外层是2个电子,少于4个,且是不稳定结构,所以容易失去最外层的两个电子,所以铁在化学反应中易失去电子;
D.地壳中含量最高的金属元素是铝,而不是铁.
(2)活性铁粉常用作脱氧保鲜剂,原理是铁和氧气、水反应生成氢氧化铁,该反应的化学方程式为 4Fe+3O2+6H2O=4Fe(OH)3;单质铁可以和硫酸铁溶液反应生成硫酸亚铁,化学反应方程式为 Fe+Fe2 (SO4)3=3FeSO4.
(3)在实验中,进行铁丝在氧气中燃烧的实验时,瓶底放少量的水或者砂子目的是 防止生成的高温的熔融物炸裂集气瓶;
在生活中为防止家中的菜刀生锈,由于菜刀表面不能涂漆,也不适合抹油当然对于已经成品的菜刀也不能在加工为合金或者不锈钢,所以可采取的方法是 保持菜刀的干燥和洁净.
(4)生物浸出技术在金属冶炼中应用广泛.嗜热细菌在酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分CuFeS2)产生硫酸盐,进而生产铜和绿矾(硫酸亚铁晶 体),主要流程如下:
①由于过程中目的是为了得到绿矾,所以不能引入新的杂质,所以加入的试剂b为铁粉; 若反应Ⅱ为中和反应是氢氧化铁和硫酸反应生成硫酸铁和水.
②现有100吨杂质质量分数为8%的黄铜矿(杂质不参与反应且不溶于水),经上述流程制得硫酸铁溶液,再向硫酸铁溶液中加入足量的铁粉,请计算能制得硫酸亚铁的质量.黄铜矿中CuFeS2的质量为100t×(1-8%)=92t.
黄铜矿中铁元素的质量为92t×$\frac{56}{64+56+32×2}$×100%=28t
因为黄铜矿中的铁全部转为硫酸铁,硫酸铁的质量为$\frac{28t}{\frac{56×2}{56×2+(32+16×4)×3}×100%}$=100t.
设制备出的硫酸亚铁的质量为x.
Fe+Fe2(SO4)3=3FeSO4
400 456
100t x
$\frac{456}{400}$=$\frac{x}{100t}$
x=114t
故填:(1 ) D;
(2)4Fe+3O2+6H2O=4Fe(OH)3;Fe+Fe2 (SO4)3=3FeSO4.
(3)防止生成的高温的熔融物炸裂集气瓶;
保持菜刀的干燥和洁净.
(4)①铁粉; 2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O.
②114t
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 滤液中一定有Ag NO3、Fe(NO3)2 | |
| B. | 滤渣中一定有铁和银 | |
| C. | 滤渣中一定有银,可能有铁 | |
| D. | 滤液中一定有Fe(NO3)2,可能有Ag NO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | BaCl2、Na2CO3、NaOH、过滤、HC1 | B. | BaCl2、NaOH、Na2CO3、过滤、HCl | ||
| C. | Na2CO3、BaCl2、NaOH、过滤、HC1 | D. | NaOH、BaCl2、Na2CO3、过滤、HC1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 石墨烯中碳元素的化合价为+4 | B. | 石墨烯的硬度小于石墨 | ||
| C. | 石墨烯属于化合物 | D. | 石墨烯的化学式为C |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com