
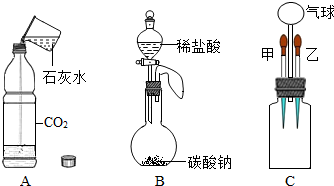
 化学小组同学设计了下列兴趣实验.
化学小组同学设计了下列兴趣实验.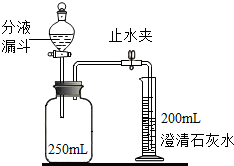
分析 (1)根据二氧化碳能与氢氧化钙反应分析回答;
(2)根据碳酸钠与盐酸的反应分析回答;
(3)根据氢氧化钙和二氧化碳反应生成碳酸钙和水进行分析;根据碳酸盐与酸反应生成二氧化碳气体分析.
(4)根据氢氧化钠与二氧化碳反应生成了碳酸钠和水分析回答.
解答 解:(1)如图A所示,向软塑料瓶中倒入适量澄清的石灰水后,迅速拧紧软塑料瓶的瓶盖,振荡,由于二氧化碳能与氢氧化钙反应生成了碳酸钙和水,观察到的现象是软塑料瓶变瘪了.
(2)如图B所示,从分液漏斗中加入稀盐酸,使其与碳酸钠粉末接触,观察到的现象是有大量的气泡生成,一段时间后,气球膨胀,其中发生反应的化学方程式是Na2CO3+2HCl═2NaCl+H2O+CO2↑,气球膨胀的主要原因是生成了二氧化碳气体,瓶内压强增大.
(3)根据题意:二氧化碳与氢氧化钙溶液反应,则气球变瘪,液体变浑浊;继续通过胶头滴管乙向其中滴入另一种液体后,振荡,发现气球又重新膨胀,液体变澄清,反应的化学方程式分别是:CO2+Ca(OH)2═CaCO3↓+H2O;CaCO3+2HCl═CaCl2+H2O+CO2↑.
(4)①氢氧化钠可以与二氧化碳反应生成碳酸钠和水,且碳酸钠能溶于水.该反应的化学方程式是:CO2+2NaOH═Na2CO3+H2O.
②由于二氧化碳能氢氧化钠反应生成了碳酸钠和水,瓶内剩余的气体应是一氧化碳,体积为:250mL-10mL-115mL=125mL,所以二氧化碳的体积是250mL-125mL=125mL.二氧化碳的体积分数是:$\frac{125mL}{250mL}×100%$=50%
故答案为:(1)软塑料瓶变瘪了;(2)有大量的气泡生成,Na2CO3+2HCl═2NaCl+H2O+CO2↑,生成了二氧化碳气体,瓶内压强增大;(3)CO2+Ca(OH)2═CaCO3↓+H2O,CaCO3+2HCl═CaCl2+H2O+CO2↑;(4)①CO2+2NaOH═Na2CO3+H2O;②50.
点评 本题的难度不大,熟悉常见物质的性质、反应的现象、压强的变化等是解答本题的基础.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:初中化学 来源: 题型:解答题
 某同学发现他家菜园中蔬菜生长迟缓,便施用了一种氮肥(一种化肥),如图是氮肥包装标签的部分文字.求:
某同学发现他家菜园中蔬菜生长迟缓,便施用了一种氮肥(一种化肥),如图是氮肥包装标签的部分文字.求:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
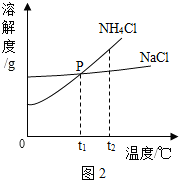
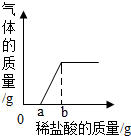 向一定量的碳酸钠和氢氧化钠混合稀溶液中滴加盐酸,发生现象可用图表示,请问:
向一定量的碳酸钠和氢氧化钠混合稀溶液中滴加盐酸,发生现象可用图表示,请问:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
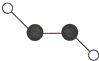 如图为某物质的分子模型示意图,其中“○”代表氢原子,“●”代表碳原子.下列叙述正确的是( )
如图为某物质的分子模型示意图,其中“○”代表氢原子,“●”代表碳原子.下列叙述正确的是( )| A. | 此物质属于混合物 | |
| B. | 此物质的化学式中碳元素的化合价为+2价 | |
| C. | 此物质的一个分子由4个原子构成 | |
| D. | 此物质中氢元素与碳元素的质量比是1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 组别 | 时间 | 铁 | 活性炭 | 空气湿度 | O2的体积分数 | 上升温度(△t) |
| 1 | 30min | 0 | 0 | 70% | 21% | 0 |
| 2 | 30min | 0 | 0.6g | 40% | 21% | 0 |
| 3 | 30min | 1.0g | 0 | 66% | 20% | 3.2℃ |
| 4 | 30min | 1.0g | 0.6g | 40% | 17% | 10.7℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com