解:(1)根据常用“三取中”的检验金属活动性的思路,可判断只用两种金属和一种溶液就可证明Fe、Cu、Al的金属活动性强弱,两种金属应为铜、铝而所取溶液应为硫酸亚铁溶液(或氯化亚铁溶液或硝酸亚铁溶液);
(2)根据金属活动性顺序镁>锌>铜>银,向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定量的锌粉,锌粉会先与硝酸银反应,待硝酸银完全反应后继续与硝酸铜反应;充分反应后过滤,向滤出的固体中加入稀硫酸;①若无气泡产生,说明锌没有剩余,则锌一定与硝酸银反应,反应的化学方程式Zn+2AgNO
3═2Ag+Zn(NO
3)
2;②若有气泡产生,则加入的锌粉过量,溶液中的硝酸银、硝酸铜全部反应,因此所得滤渣含有银、铜、锌三种金属;而溶液为反应生成的硝酸锌与未反应硝酸镁的混合溶液,则溶液中所含离子为Zn
2+、Mg
2+;
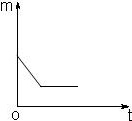
(3)将铁加入到盛有一定质量的硫酸铜溶液的烧杯中,铁与硫酸铜反应生成硫酸亚铁和铜,根据反应的化学方程式可知每56份质量的铁可置换出64份质量的铜,因此随着反应的发生,溶液的质量逐渐减小,直到硫酸铜或铁粉完全反应,溶液质量不再变化;
故答案为:
(1)FeSO
4[或FeCl
2或Fe(NO
3)
2];
(2)①Zn+2AgNO
3═2Ag+Zn(NO
3)
2;②Ag,Cu,Zn;Zn
2+、Mg
2+;
(3)
.
分析:(1)根据检验三种金属活动性常采取“三取中”的方法设计实验,推断只用两种金属和一种溶液就可证明Fe、Cu、Al的金属活动性强弱所选取的溶液;
(2)根据金属活动性顺序,判断向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定量的锌粉,判断当锌粉不剩余或剩余时发生反应的情况;
(3)根据金属铁与一定质量的硫酸铜溶液反应的事实,分析反应后溶液质量的变化,绘制烧杯中溶液质量(m)随时间(t)变化的关系图.
点评:“三取中”检验金属活动性的方法为:取三种金属中中间金属与两端金属的盐溶液反应或取中间金属的盐溶液与两端金属反应.


 .
.