
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 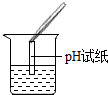 |  |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
分析 【学生板演】根据硫酸和氢氧化钠反应生成硫酸钠和水,注意化学式的写法和化学方程式的配平;
【假设猜想】根据酸碱不能共存判断不合理的猜想;
【实验探究】(1)根据“滴加几滴CuSO4溶液,无明显变化”,进行推测无氢氧根,故溶液中一定没有 NaOH.
(2)根据碳酸钠和硫酸反应能生成二氧化碳气体解答;
【评价反思】(1)根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中;
(2)检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀.
解答 解:【学生板演】根据硫酸和氢氧化钠反应生成硫酸钠和水,故化学方程式为H2SO4+2NaOH═Na2SO4 +2H2O;
【假设猜想】根据硫酸和氢氧化钠反应生成硫酸钠和水,酸或碱可能过量:当H2SO4过量时,猜想二:有Na2SO4和H2SO4合理;
当氢氧化钠过量时,反应后溶液中的溶质为硫酸钠和氢氧化钠,故猜想三合理;而猜想四为有Na2SO4、H2SO4和NaOH,酸碱不能同时过量,因为酸碱不能共存,会继续反应,故猜想四不合理;
【实验探究】(1)硫酸铜和氢氧化钠反应能生成氢氧化铜蓝色沉淀,因此溶液中滴加几滴CuSO4溶液,无明显变化,说明溶液中一定没有氢氧化钠.
(2)溶液中有硫酸,滴加碳酸钠后,碳酸钠会和硫酸反应生成二氧化碳气体,因此会看到产生气泡.
【评价反思】(1)根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中,应用玻璃棒蘸取少量溶液涂到pH试纸上;
(2)检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀,故不能证明溶液中一定存在硫酸;
故答案为:
H2SO4+2NaOH═Na2SO4+2H2O; 猜想四或四; NaOH或氢氧化钠;
有气泡产生; pH试纸直接浸入溶液中;
BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在(其他合理答案均可)
点评 此题通过中和反应考查了化学方程式的书写,实验方案设计、实验操作以及实验方案的评价,解答时要全面审题,认真解答.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水蒸发变成水蒸气 | B. | 将胆矾晶体研磨变细 | ||
| C. | 氧化汞分解得到汞和氧气 | D. | 将空气加压降温变为液态空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 “双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体.某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示.同学们对这包久置的“504双吸剂”的固体样品很好奇,设计实验进行探究.
“双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体.某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示.同学们对这包久置的“504双吸剂”的固体样品很好奇,设计实验进行探究.| 实验操作 | 实验现象 | 实验结论 |
| 一、取少量固体加入足量蒸馏水,搅拌溶解 | 固体部分溶解,并放出大量热 | 固体中一定含有CaO |
| 二、过滤,取滤液滴加无色酚酞试液 | 溶液变红色 | 固体中一定含有氢氧化钙 |
| 三、取滤渣加入足量稀盐酸 | 固体逐渐消失,产生大量无色气体,得到浅绿色溶液 | 固体中一定含有铁粉,一定不含有Fe2O3 |
| 四、将操作三中产生的气体通入到澄清石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 加热时间(min) | 0 | T1 | T2 | T3 |
| B中固体质量(g) | 6.66 | 5.20 | 4.80 | 4.80 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com