
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
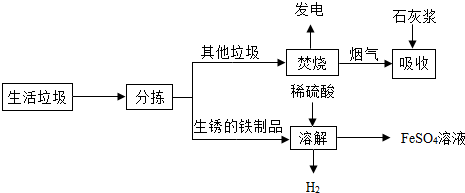
分析 (1)发电厂是利用垃圾焚烧产生的热能转变为电能;
(2)根据石灰浆是碱性分析;
(3)化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”;
(4)根据制取硫酸亚铁晶体的基本操作解答;
(5)根据图表中的信息可以知道当温度大于64℃时产生了FeSO4•4H2O,可以据此解答该题;
(6)根据题给的信息可以判断无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁、二氧化硫和三氧化硫,可以据此写出该反应的化学方程式.
(7)生活垃圾分类回收等.
解答 解:
(1)发电厂是利用垃圾焚烧产生的热能转变为电能;
(2)石灰浆显碱性,能够吸收酸性气体,所以吸收步骤中,石灰浆的作用是除去烟气中含有的SO2、HCl;反应的化学方程式为:盐酸和氢氧化钙反应生成氯化钙和水,反应的化学方程式为:2HCl+Ca(OH)2═CaCl2+2H2O.:氢氧化钙和二氧化硫反应生成亚硫酸钙和水,反应的化学方程式为:SO2+Ca(OH)2═CaSO3↓+H2O.
(3)溶解步骤中,硫酸与铁反应,生成氢气,所以产生的H2的化学方程式为Fe+H2SO4═FeSO4+H2↑;
(4)操作②的目的是得到硫酸亚铁铵晶体,基本操作步骤:加热浓缩,然后冷却结晶;再过滤;最后洗涤干燥,得到硫酸亚铁晶体,其中氮气的作用是作保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)根据图表中的信息可以知道当温度大于64℃时产生了FeSO4•4H2O,所以应该将温度控制在64℃以下;
(6)通过题给的信息可以判断无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和三氧化硫,在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等,所以结合元素化合价的变化可以知道,铁元素的化合价由+2变成了+3价,所以反应中有二氧化硫生成,硫元素的化合价由+6降低到+4,所以根据质量守恒定律可以判断在该反应中还生成了三氧化硫,
所以该反应的化学方程式为:2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(7)请你就成都市生活垃圾处理提一条建议生活垃圾分类回收等.
故答案为:
(1)热;
(2)2HCl+Ca(OH)2═CaCl2+2H2O;
(3)Fe+H2SO4═FeSO4+H2↑;
(4)保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)不超过64℃;
(6)2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(7)生活垃圾分类回收等.
点评 在解此类题时,应掌握化学方程式的书写、盐的化学性质等知识,并学会分析信息、提取信息,并根据所学知识结合所给信息进行解答.此题涉及的知识点较多,有一定的难度,需要同学们能够掌握全面的知识.


科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 选项 | 待区分的物质 | 鉴别方法 |
| A | 合成纤维和纯羊毛 | 取样,分别灼烧,并闻气味 |
| B | CaCl2溶液和NaCl溶液 | 取样,分别加入硝酸银溶液,观察是否产生沉淀 |
| C | 稀盐酸和稀硫酸 | 取样,分别AgNO3溶液,观察是否产生沉淀 |
| D | 碳粉和氧化铜 | 取样,分别加入足量稀硫酸,观察是否能溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验方法 | 现象 | 结论 |
| 取样,溶于水后过滤 | 得到无色溶液和黑色固体 | 是氯化钾和二氧化锰 |
| 实验方法 | 现象 | 结论和反应的符号表达式 |
| 猜想正确 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com