
【题目】两个化学兴趣小组分别进行以下3个实验:
①MgSO4溶液和NaOH溶液反应;
②稀H2SO4和BaCl2溶液反应
③稀HCl和NaOH溶液反应(用酚酞试液作指示剂)
实验结束后,同学们发现本组废液缸里废液颜色与另一小组不一样,在征得老师同意后,两组同学各自对本小组的废液进行探究:
【提出问题】废液缸里的废液成分有什么?
【查阅资料】微溶物质在反应物中视作可溶物,在生成物中视为不溶物。
【实验探究】
(一)第1小组的探究:
1.小东首先把呈浑浊状态的废液进行分离,得红色澄清滤液和滤渣。
2.小刚认为无需进行实验,就能判断出滤渣中含有BaSO4、Mg(OH)2两种沉淀,他的理由是 ,请你写出生成其中一种沉淀的化学方程式: 。
3.小西对滤液成分(除酚酞、水外,下同)进行分析,认为滤液中一定含NaOH和NaCl,并对可能有的成分提出如下猜想:
猜想1:滤液中含有BaCl2
猜想2:滤液中含有Na2SO4
猜想3:滤液中含有BaCl2、Na2SO4
(1)小强认为猜想3是不成立的,因为 ;
(2)小雨取少量滤液于试管中,滴加 溶液,出现的现象是 ,证明猜想2成立。
(二)第2小组的探究:
第2小组首先对废液进行了分离,得无色滤液和少量滤渣,然后取少量滤液于试管中,逐滴滴加Na2CO3溶液,并根据实验结果绘制成下图。请据此判断,滤液一定含有的离子是 (填离子符号),实验过程中滤液颜色的变化为 。
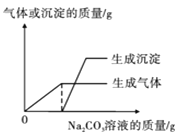
【交流反思】实验结束后,同学们一致认为实验后的废液要进行处理才能排放,否则会对环境造成污染。
【答案】(一)2.BaSO4不溶于水也不溶于酸和碱(0.5分),由题可知,由于NaOH过量,Mg2+基本上以Mg(OH)2沉淀的形式存在(0.5分)。2NaOH + MgSO4 = Na2SO4 + Mg(OH)2↓或BaCl2 + H2SO4 = BaSO4↓+ 2HCl 或 Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl 3.
(1)BaCl2、Na2SO4能相互发生化学反应,不能共存。
(2)BaCl2或Ba(NO3)2或Ba(OH)2等
产生白色沉淀(二)H+、Mg2+、Na+、Cl-(全对1分,其他答案不给分) 无色变为红色
【解析】
试题分析:(一)第1小组的探究:2、有题中叙述可知混合液显碱性,滤渣中含有BaSO4、Mg(OH)2两种沉淀,理由BaSO4不溶于水也不溶于酸和碱;由于NaOH过量, Mg2+基本上以Mg(OH)2沉淀的形式存在;生成其中一种沉淀的化学方程式:2NaOH + MgSO4 = Na2SO4 + Mg(OH)2↓或BaCl2 + H2SO4 = BaSO4↓+ 2HCl 或 Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl;3、(1)小强认为猜想3是不成立的,因为BaCl2、Na2SO4能相互发生化学反应,不能共存。(2)小雨取少量滤液于试管中,滴加可溶性钡盐溶液,出现的现象是白色沉淀,证明猜想2成立。(二)第2小组的探究 加入碳酸钠溶液产生气体,说明滤液显酸性,存在氢离子;氢氧化钠和盐酸反应生成的氯化钠一定在滤液中,因此滤液中存在氯离子和钠离子;滤液能和碳酸钠反应生成沉淀,说明溶液中有镁离子或钡离子或镁离子、钡离子都有,但滤液显酸性,镁离子不形成沉淀,而酸性溶液中,钡离子和硫酸根离子能形成沉淀,所以滤液中一定有镁离子,钡离子不确定。;因为碳酸钠溶液显碱性,实验过程中滤液颜色的变化为无色变为红色。


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:
【题目】(9分)某小组同学利用如图所示装置探究铁生锈的条件,其中C、D的分液漏斗中为足量且浓度和体积均相同的稀盐酸。
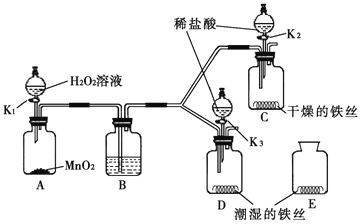
(1)步骤一:关闭K2和K3,打开K1,A中反应的化学方程式是 ,B中所盛放的试剂是 。对比铁丝表面的变化,能够说明铁生锈与水有关的是装置 和 (填C、D或E,下同),能够说明铁生锈的快慢与氧气浓度有关的是装置 和 。
(2)步骤二:关闭K1,打开K2和K3,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,两个广口瓶中现象的不同点是:① ;② ,由此也可以判断铁丝生锈情况。C中反应的化学方程式是 。
(3)温度会影响铁生锈的快慢,请设计实验加以证明: 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化碳是重要的资源。以二氧化碳和钠为原料,在440 ℃和800个标准大气压下,可得到直径最大达1.2 mm的金刚石。下列说法中,正确的是
A.钠属于非金属单质 B.上述反应是化合反应
C.二氧化碳发生了还原反应 D.钠和空气在上述条件下也可制得金刚石
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)运用“线索~体系”法,理清知识线索,构建知识体系,有利于全面、系统的掌握物质的化学性质。下面是对盐化学性质进行的归类,请填写所缺内容。
(1)有些盐高温可发生 反应,如CaCO3![]() 2CaO + CO2↑;
2CaO + CO2↑;
(2)有些盐可与些某些 反应,如CuSO4 + Fe == Fe SO4 + Cu;
(3)有些盐可以与某些 反应,如CaCO3 + 2HCl == CaCl2 + H2O + CO2↑;
(4)有些盐可以与某些 反应,如CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓;
(5)有些盐可以与某些 反应,如CuSO4 + BaCl2 == CuCl2 + BaSO4↓。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示:A~F是初中化学常见的物质。在常温下,A为红色固体,E为黑色固体单质,B、C、D均为无色气体,F为常用建筑材料的主要成分。请回答下列问题:
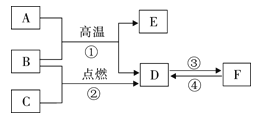
(1)F的化学式 ;
(2)D的固态形式叫 ;
(3)写出C物质的一种用途: ;
(4)反应①的化学方程式: ;
(5)B、D两种物质的组成元素相同,但性质不同,原因是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】电解水实验中可直接观察到的现象是( )
A.水由氢氧元素组成
B.有氢气和氧气产生,且体积比约2:1
C.两电极管中均产生气泡
D.一个水分子由二个氢原子和一个氧原子构成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)人类的生活和生产都离不开金属。
(1)下列矿石的主要成分属于氧化物的是 (填序号)。

(2)铁是应用最广泛的金属。
①生活中用铁锅做炊具,利用铁的 性;
②铁制品锈蚀的过程,实际上是铁跟空气中 和水蒸气等发生了化学反应。防止铁栏杆生锈,通常采取的措施是 (写一条)。
(3)已知金属M和N能够发生如下反应:M+H2SO4==MSO4+H2 Fe+MCl2==M+FeCl2
N+FeCl2==Fe+NCl2判断Fe、Cu、M、N的活动性由强到弱的顺序是 ;以上化学反应均属于 (填基本反应类型).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com