
 某化学兴趣小组在做完用石灰石和稀盐酸制取二氧化碳的实验后,对反应后的剩余溶液的溶质成分产生了兴趣,他们进行了以下实验探究.
某化学兴趣小组在做完用石灰石和稀盐酸制取二氧化碳的实验后,对反应后的剩余溶液的溶质成分产生了兴趣,他们进行了以下实验探究.| 方案编号 | 方案1 | 方案2 | 方案3 |
| 实验操作 (分别取少量实验后的溶液于试管中) |  | 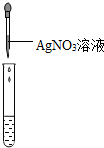 |  |
| 实验现象 | 对照标准比色卡: pH<7. | 产生白色沉淀. | 先有气体产生,后有白色沉淀生成. |
| 实验结论 | 猜想二成立. | ||
分析 根据已有的知识进行分析解答,制取二氧化碳可以使用碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;根据实验操作的注意实现结合图示、以及物质的性质和物质间反应的实验现象进行解答.
解答 解:【提出猜想】碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;
【实验探究】盐酸能与碳酸钠反应生成二氧化碳气体,碳酸钠能与氯化钙反应生成碳酸钙沉淀,故会观察到先有气体产生,后有白色沉淀生成,故填:先有气体产生,后有白色沉淀生成;
【评价反思】
(1)①据图可以看出,操作中的错误是pH试纸浸入溶液中,故填:pH试纸浸入溶液中;
②即使没有盐酸,AgNO3与CaCl2反应也会生成白色沉淀,不能证明一定有HCl存在,故填:AgNO3与CaCl2反应也会生成白色沉淀,不能证明一定有HCl存在;
(2)石灰石是混合物,剩余固体可能是石灰石中的杂质,故填:剩余固体可能是石灰石中的杂质;
【拓展延伸】
(1)解:设20g碳酸钠溶液中溶质的质量为X
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
X 5g
$\frac{106}{100}=\frac{X}{5g}$
X=5.3g
Na2CO3%=$\frac{5.3g}{20g}$×100%=26.5%
答:该Na2CO3溶液中溶质的质量分数为26.5%.
(2)想从剩余溶液中得到尽可能多的氯化钙固体可以加入稍过量的碳酸钙,故填:CaCO3.
点评 本题考查的是剩余物质成分的探究,完成此题,可以依据已有的物质的性质进行.


科目:初中化学 来源: 题型:选择题
 将燃着的镁带伸入二氧化碳气体中,镁带继续剧烈燃烧,生成氧化镁和碳.下列叙述错误的是( )
将燃着的镁带伸入二氧化碳气体中,镁带继续剧烈燃烧,生成氧化镁和碳.下列叙述错误的是( )| A. | 一定条件下CO2有助燃性 | |
| B. | 反应的化学方程式为:2Mg+CO2$\underline{\underline{点燃}}$2MgO+C | |
| C. | 一定条件下CO2有可燃性 | |
| D. | 镁着火时不能用二氧化碳扑灭 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
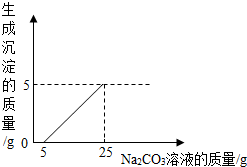
 有一溶液是由盐酸、硫酸、硫酸铁、氯化铁、稀硝酸、硝酸铁几种中的两种混合而成,向该溶液中加Ba(OH)2溶液的体积与生成沉淀的质量关系如图所示,则该溶液是( )
有一溶液是由盐酸、硫酸、硫酸铁、氯化铁、稀硝酸、硝酸铁几种中的两种混合而成,向该溶液中加Ba(OH)2溶液的体积与生成沉淀的质量关系如图所示,则该溶液是( )| A. | 硝酸、硝酸铁 | B. | 硫酸、氯化铁 | C. | 盐酸、氯化铁 | D. | 盐酸、硫酸铁 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| ?取上述试管中的上层清液,滴加1─2滴无色酚酞试液 | 溶液呈红色 | 白色粉末中含有Ca(OH)2 |
| ?往上述试管残留的白色固体中滴加稀盐酸 | 有气泡产生 | 白色粉末中含CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 滴入澄清石灰水,观察是否浑浊 | |
| B. | 将带火星小木条伸入,观察是否复燃 | |
| C. | 加入MnO2,观察是否产生气泡 | |
| D. | 将燃着的小木条伸入,观察是否更旺 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | y g | B. | $\frac{12x}{y}$g | C. | $\frac{y}{x}$ | D. | $\frac{12y}{x}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com