
分析:H2SO4和BaCl2反应生成BaSO4和HCl,再用NaOH中和剩余H2SO4时,不能忽视NaOH又和生成HCl发生反应的这个隐蔽反应,而且这个反应是解题时不走弯路的关键。
【常规解法】(l)设BaCl2消耗H2SO4的质量为x,反应生成HCl的质量为y
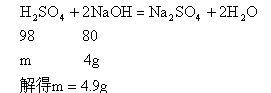 (2)设HCl消耗NaOH的质量为z
(2)设HCl消耗NaOH的质量为z
在反应中共消耗NaOH质量为32g×25%=8g,中和HCl用去4g,尚余4g
 (3)设4gNaOH中和的H2SO4质量为m
(3)设4gNaOH中和的H2SO4质量为m
硫酸中溶质的质量分数为
 答案:(略)
答案:(略)
【解法二】此题稍加分析,即可一步解出:用BaCl2的量不能求出H2SO4的量是因BaCl2不足量,而用NaOH的量却可求出H2SO4的量,因二者是完全中和的反应。之所以可用NaOH 而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
设:H2SO4的量为x

硫酸中溶质的质量分数为 答案:(略)
答案:(略)
 天天练口算系列答案
天天练口算系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
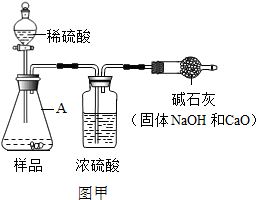 (2013?丽水)工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究.
(2013?丽水)工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究.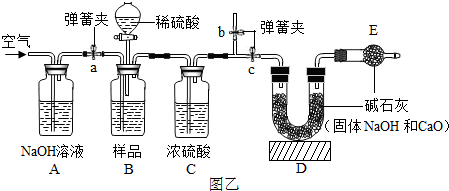 图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的开闭情况是
图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的开闭情况是查看答案和解析>>
科目:初中化学 来源: 题型:
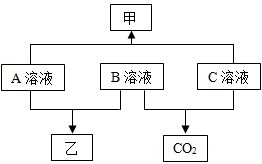 (2012?贺州)A、B、C分别是初中化学常见的酸、碱、盐中的一种,均易溶于水,甲、乙是两种难溶于水的白色固体,并且乙不溶于稀硝酸,B的浓溶液可作为干燥剂使用,他们之间的转化关系如图所示:(图中连线表示物质间能发生反应,箭头表示生成)
(2012?贺州)A、B、C分别是初中化学常见的酸、碱、盐中的一种,均易溶于水,甲、乙是两种难溶于水的白色固体,并且乙不溶于稀硝酸,B的浓溶液可作为干燥剂使用,他们之间的转化关系如图所示:(图中连线表示物质间能发生反应,箭头表示生成)查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
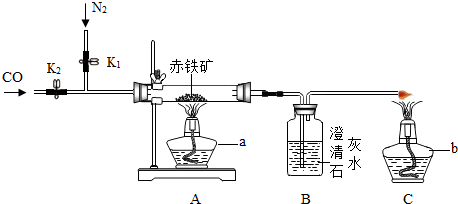
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com