
【题目】某学习小组做镁带在空气中燃烧实验时,发现生成物中有黑色固体.针对这一现象,他们开展了如下探究活动.请仔细阅读并完成下列探究报告.
(探究目的)探究镁在空气中燃烧产生的黑色固体是镁与空气中什么物质反应产生的.
(分析猜想)分析空气中各种成分,寻找猜想依据.
空气成分之一:_____,化学性质稳定,一般不与其他物质反应.
空气成分分之二:氧气,氧气与镁反应生成的氧化镁是白色固体.
空气成分之三:水蒸气,打磨光亮的镁带放入沸水中,表面会附有白色固体并产生大量气泡;再向沸水中滴入无色酚酞试液,呈现红色,如果将镁带放到水蒸气中,也会发生上述反应,但产生的不是黑色固体.
空气成分之四:氮气、二氧化碳.猜想:可能是镁与N2或CO2反应生成黑色固体.
(实验一)镁带与氮气的反应
获取氮气
(1)把空气液化,然后蒸发,先蒸发出来的气体就是氮气,这种方法属于_____变化,但在实验室里空气不易被液化.
(2)以下是获取氮气的方法及装置(装置中使用的固体药品均过量),其中得到氮气较纯的是_____.(填字母)

(二)燃烧镁带,观察现象
将镁带打磨光亮,点燃,伸入盛N2的集气瓶中,配内壁附着一层淡黄色的固体.
(三)实验结论:镁与氮气在点燃的条件下发生化合反应生成淡黄色的氮化镁(Mg3N2).该反应的文字表达式是_____.
(实验二)将燃着的镁带伸入盛CO2的集气瓶中,镁带剧烈燃烧,瓶内出现白色固体和黑色固体.CO2与镁发生反应,根据所学知识猜想生成的黑色固体物质是_____.
(探究结论)镁在空气中燃烧产生的黑色固体是镁与空气中CO2反应产生的.
【答案】稀有气体 物理 B 镁+氮气![]() 氮化镁 碳
氮化镁 碳
【解析】
[分析猜想]空气成分之一:空气中的稀有气体化学性质不活泼,一般不与其它物质反应;
[实验一](一)获取氮气:(1)把空气液化,然后蒸发,先蒸发出来的气体就是氮气,分离过程中没有新物质生成,属于物理方法;
(2)硫磺在空气中能够燃烧生成二氧化硫气体,虽除去氧气,而增加了新的气体二氧化硫,尽管石灰水能吸收二氧化硫,但由于氢氧化钙的溶解度较小,石灰水中溶解的氢氧化钙较少,不能全部吸收二氧化硫,不能得到较纯净的氮气;
红磷本身是固体,在空气中燃烧,且生成物五氧化二磷是固体,可以用于除去空气中的氧气;且氢氧化钠溶液能吸收空气中的二氧化碳,能得到较纯的氮气;
木炭在空气中燃烧生成二氧化碳气体或者一氧化碳气体甚至是两者的混合气体,虽除去氧气,而增加了新的气体,不能得到较纯净的氮气;
(三)镁与氮气在点燃的条件下发生化合反应生成淡黄色的氮化镁,反应的文字表达式为:镁+氮气![]() 氮化镁;
氮化镁;
[实验二]将燃着的镁带伸入盛CO2的集气瓶中,镁带剧烈燃烧,瓶内出现白色固体和黑色固体;CO2与镁发生了置换反应,生成物为氧化镁和碳,黑色固体物质是碳。


科目:初中化学 来源: 题型:
【题目】请根据下列装罝回答问题:
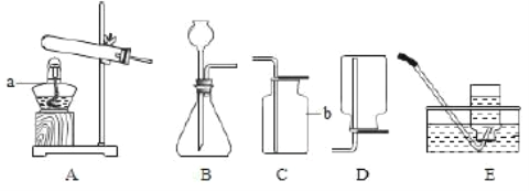
(1)写出标号仪器名称:a_________;b________。
(2)实验室用高锰酸钾制取并收集干燥的氧气时,装罝应选用_______(填字母),该发生装罝不足之处是________,所发生反应的化学方程式为_________,若用E装罝收集,判断氧气是否收集满的方法是______。氧气收集完毕后,测得其纯度明显偏低,原因可能是:______(填字母,可多选);
(A)高锰酸钾中混入了二氧化锰 (B)收集前,集气瓶中未注满水
(C)收集后,集气瓶中仍有少量水 (D)加热前就将导管伸入集气瓶
(3)将 30.9g 氯酸钾(KClO3)和二氧化锰的固体混合物装入试管中,加热制取氧气,同时生成氯化钾。待反应完全后,将试管冷却,称量,可以得到21.3g 固体物质。请计算原固体混合物中氯酸钾的质量_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组同学进行如下实验探究。
(一)实验室常用的制取气体的装置如下:
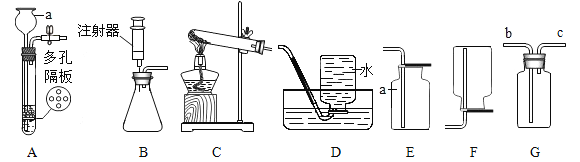
(1)仪器 a 的名称_________。
(2)实验室制二氧化碳的反应方程式为________________________________,该反应属于________________(填写基本反应类型)
(3)实验室用过氧化氢溶液和二氧化锰粉末混合制取氧气,选用的装置组合可以是______,装置B中注射器的作用是______________。
(4)若用G装置收集氧气,写出验满的方法____________________,用制得的氧气做铁丝燃烧实验时没看见火星四射,原因可能是 _____________________。
(5)某同学用一定浓度盐酸与石灰石在一个密闭性良好的装置里反应,将生成的气体通入澄清石灰水中,始终未见浑浊,造成此现象的可能原因:______________________________
(二) 碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。化学小组查得以下资料:
Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI + O2 + 2CO2 == 2K2CO3 + 2I2
乙:4KI + O2 + 2H2O == 4KOH + 2I2
Ⅱ.KOH与NaOH的化学性质相似。
为探究碘化钾变质原理的合理性,开展以下实验。
(实验过程)
[实验1]取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
① 石灰水变浑浊的原因是_______________________________(用化学方程式表示)。
② 化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是____________________________________。
[实验2]如下图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
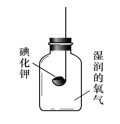
③ 据此现象,可得出的结论是_____________________________ 。
[实验3]按下图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。
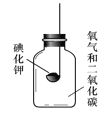
化学小组据此改进实验,很快观察到固体泛黄的现象。
(实验结论)④ 根据上述实验,化学小组得出结论,碘化钾固体泛黄变质是碘化钾与_______________共同作用的结果。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“冰七”(iceⅦ)一般是在深海中强压力作用下才可以形成的固态水,水分子会整齐排列成排或排成一列非常整齐有规则的冰晶,像是一个立方体的牢笼裹合物。下列说法正确的是( )
A. 单个水分子可以形成“冰七”
B. “冰七”中的水分子不再运动
C. 海水在一定条件下可以形成“冰七”
D. “冰七”和水的化学性质不完全相同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是实验室里制取气体是常用到的部分仪器。

⑴在实验室里,利用化学反应2KClO3![]() 2KCl+3O2↑来制取氧气。
2KCl+3O2↑来制取氧气。
①除选用上图中的部分仪器外,还必须补充的玻璃仪器是_____。
②蜡烛燃烧实验中用到的氧气,最好采用_____法收集。
⑵用上述部分仪器制取CO2
①选择C的优点是_____。
②若要用73g10%的稀盐酸与足量的大理石反应,理论上制取_____gCO2。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学梳理归纳以下知识:
![]() “粗盐中难溶性杂质的去除”的实验中,当蒸发皿中出现较多量固体时,停止加热;
“粗盐中难溶性杂质的去除”的实验中,当蒸发皿中出现较多量固体时,停止加热;
![]() 生成盐和水的反应一定是中和反应;
生成盐和水的反应一定是中和反应;
![]() 升高温度或减小压强,气体的溶解度均会减小;
升高温度或减小压强,气体的溶解度均会减小;
![]() 能使无色酚酞溶液变红的一定是碱溶液;
能使无色酚酞溶液变红的一定是碱溶液;
![]() 一氧化碳、二氧化碳均属于非金属氧化物,它们都能和碱溶液反应;
一氧化碳、二氧化碳均属于非金属氧化物,它们都能和碱溶液反应;
![]() 用湿润的pH试纸测定稀硫酸溶液的pH,会使得pH偏大;
用湿润的pH试纸测定稀硫酸溶液的pH,会使得pH偏大;
![]() 的酸性降水称为酸雨,它的形成与大气中
的酸性降水称为酸雨,它的形成与大气中![]() 等酸性污染物增多有关:
等酸性污染物增多有关:
其中正确的个数是![]()
![]()
A. 1个B. 2个C. 3个D. 4个
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】自来水消毒过程中通常会发生如下化学反应,其反应的微观过程可用如图表示:
(![]() 表示氯原子,
表示氯原子,![]() 表示氧原子,
表示氧原子,![]() 表示氢原子)
表示氢原子)
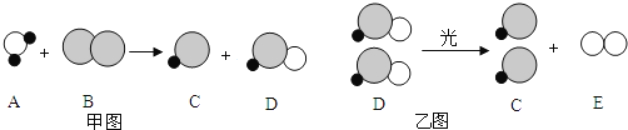
(1)请写出甲图所示反应的化学方程式_____;
(2)乙图所示反应的基本反应类型为_____;
(3)上述物质中,属于单质的有_____(填化学式);
(4)以甲图为例分析,你能总结出的一条结论是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取5 g样品,加入27 g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH。当pH=7时,刚好用去10%的稀盐酸36.5 g。试计算:
(1)将100 g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需加水的质量为 g。
(2)样品中氢氧化钠的质量分数。
(3)反应后所得溶液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂从含铜废料中回收铜的生产流程如下.(提示:铜灼烧后的固体可以与稀硫酸反应生成硫酸铜和水;含铜废料中,除铜外其余物质不与氧气或稀硫酸反应且不溶于水。)

(1)“酸浸”步骤需加热。写出该步骤发生反应的化学方程式____________________。
(2)操作Ⅰ的名称是________,经操作Ⅰ分离所得溶液中含有的微粒有_______(填微粒符号)和H2O。
(3)过量试剂X与操作Ⅰ分离所得溶液发生反应,写出相关的化学方程式:____________。
(4)请补充完整由固体物质Y得到铜粉的实验方案:向固体物质Y中_____________,用水洗涤固体2~3次,干燥得到铜粉。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com