
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
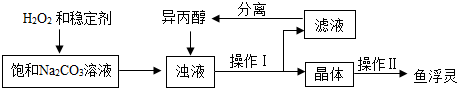
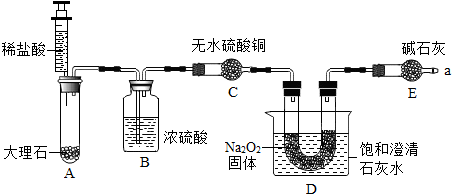
分析 (1)氧气能使带火星的木条复燃;
(2)二氧化碳能使澄清石灰水变浑浊;
(3)氯化镁和硅酸钠反应生成硅酸镁和氯化钠;
(4)过碳酸钠在异丙醇中的溶解度很小;
(5)利用异丙醇洗涤晶体时,晶体不溶于流失;
(6)根据表中提供的数据可以判断上述制备反应的最佳温度范围;
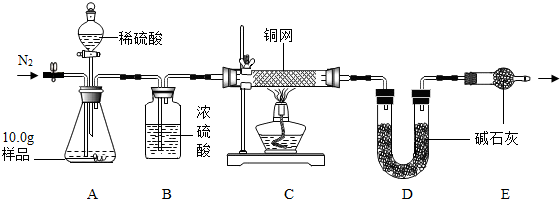
(7)氮气的化学性质不活泼,一般情况下不能和其它物质发生化学反应;
(8)若先滴入稀硫酸,后加热铜网,将使部分氧气散逸,计算时过氧化氢相对含量偏小,碳酸钠相对含量偏大,导致x:y的值偏大;
(9)装置B的作用是干燥气体,防止水分进入D装置使测定值偏大;同时便于观察和控制气流速度以使反应充分进行;
(10)根据提供的数据可以判断相关方面的问题.
解答 解:(1)将带火星木条伸入试管,木条复燃,说明有O2生成.
故填:复燃.
(2)将产生的气体通入澄清石灰水中,出现浑浊现象,说明有二氧化碳生成.
故填:二氧化碳.
(3)稳定剂的作用是防止过碳酸钠分解;
氯化镁和硅酸钠反应的化学方程式为:MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
故填:防止过碳酸钠分解;MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
(4)浊液中加入异丙醇的作用是减少过碳酸钠的溶解.
故填:减少过碳酸钠的溶解.
(5)操作Ⅱ中洗涤晶体的试剂最好选用异丙醇.
故填:C.
(6)根据下表数据可知,10~15℃时,活性氧含量和“鱼浮灵”的产率都是最高值,因此上述制备反应的最佳温度范围是10~15℃.
故填:10~15.
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是:实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收.
故填:实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收.
(8)若先滴入稀硫酸,后加热铜网,将使部分氧气散逸,计算时过氧化氢相对含量偏小,碳酸钠相对含量偏大,导致x:y的值偏大.
故填:偏大.
(9)装置B的作用是干燥气体,防止水分进入D装置使测定值偏大;同时便于观察和控制气流速度以使反应充分进行.
故填:①②.
(10)C装置中铜网增重1.2g,则说明生成氧气的质量为1.2g,氧气质量占样品的百分数(活性氧含量)为12%大于10.5%而小于13%,属于合格品;
由氧气质量可计算过氧化氢质量为2.55g;
D装置增重2.2g,说明生成二氧化碳2.2g,计算反应的碳酸钠质量为5.3g,则可得:106x:34y=5.3g:2.55g 解得x:y=2:3.
故填:12%;合格品;2:3.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 (1)该反应的化学方程式为:H2SO4+2NaOH=Na2SO4+2H2O.
(1)该反应的化学方程式为:H2SO4+2NaOH=Na2SO4+2H2O.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CaH2 | B. | H2O | C. | Ca(OH)2 | D. | H2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com