
【题目】某次实验结束时,将含有CuSO4、ZnSO4、 FeSO4 的废液倒在废液缸里,考虑到废液直接排放会造成水污染,某化学活动小组利用课余时间处理废液,回收工业重要原料硫酸锌和有关金属。实验流程如下:

(1)步骤①中锌粉必须过量的目的是让废液中的______________完全反应。该流程中发生的置换反应共有_________个。 写出步骤③反生的反应的化学方程式______________。
(2)若实验过程中的物质损失可以忽略,要测定废液中的硫酸锌的质量分数,除了需要测定废液的质量、多步处理所得到的固体ZnSO4的质量,还需要测量______________这一种物质的质量。
(3)若在上述实验流程的基础上,只需要补充一个实验方案, 即可得出金属活动性Cu<H<Fe<Zn,写出实验操作及现象。________
【答案】硫酸铜、硫酸亚铁 3 ![]() 过量锌粉 将打磨过的铁片放入少量稀硫酸中,发现有气泡生成
过量锌粉 将打磨过的铁片放入少量稀硫酸中,发现有气泡生成
【解析】
(1)步骤①中锌粉必须过量的目的是让废液中的硫酸铜、硫酸亚铁完全反应;
在废液中加入过量锌粉,锌和硫酸铜反应生成硫酸锌和铜,该反应的化学方程式为:![]() ,锌和硫酸亚铁反应生成硫酸锌和铁,该反应的化学方程式为:
,锌和硫酸亚铁反应生成硫酸锌和铁,该反应的化学方程式为:![]() ,过滤,固体A中为铜、铁和过量的锌粉,用磁铁使铁和铜、锌分离,固体C为铜和锌,加入适量稀硫酸,铜不与稀硫酸反应,锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:
,过滤,固体A中为铜、铁和过量的锌粉,用磁铁使铁和铜、锌分离,固体C为铜和锌,加入适量稀硫酸,铜不与稀硫酸反应,锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:![]() ;
;![]() ,
,![]() ,
,![]() 都符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应,故置换反应有3个;
都符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应,故置换反应有3个;
步骤③反生的反应的化学方程式为:![]() ;
;
(2)要测定废液中的硫酸锌的质量分数,除了需要测定废液的质量、多步处理所得到的固体ZnSO4的质量,还需要测量过量锌粉这一种物质的质量,由![]() ,
,![]() ,
,![]() 可知,过量锌粉全部转化为了硫酸锌,可通过锌粉的质量推算出反应生成的硫酸锌的质量,通过多步处理所得到的固体ZnSO4的质量减去反应生成的硫酸锌的质量,即可得出废液中硫酸锌的质量,继而计算出废液中硫酸锌的质量分数;
可知,过量锌粉全部转化为了硫酸锌,可通过锌粉的质量推算出反应生成的硫酸锌的质量,通过多步处理所得到的固体ZnSO4的质量减去反应生成的硫酸锌的质量,即可得出废液中硫酸锌的质量,继而计算出废液中硫酸锌的质量分数;
(3)通过上述实验流程可知,锌能与硫酸铜、硫酸亚铁反应,说明在金属活动性顺序里,锌位于铁、铜之前,铜不与稀硫酸反应,说明在金属活动性顺序里,铜位于氢之后,现在只需证明在金属活动性顺序里,铁位于氢之前即可,故实验方案为:将打磨过的铁片放入少量稀硫酸中,发现有气泡生成,说明在金属活动性顺序里,铁位于氢之前。


科目:初中化学 来源: 题型:
【题目】五氧化二钒( V2O5)是一种重要的催化剂,下图是制取V2O5的工艺流程图。

(1)操作a的名称是_____________________。
(2)反应①的化学方程式为___________________。
(3)从氯化钾溶液中可获得副产品氯化钾。氯化钾还是一种常见的化肥,属于___________________肥。
(4)反应②是分解反应,物质X由两种元素组成,,其化学式为___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
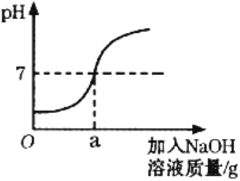
【题目】用溶质质量分数为5%的NaOH溶液中和73g的稀盐酸,反应过程中溶液的酸碱度变化如图所示。请计算
(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水_____克。
(2)当a为80g时,所得溶液中溶质的质量分数是多少____________(结果精确到0.1%)?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镓是一种奇妙的金属,放在手心马上熔化,犹如荷时上的水珠流来流去。
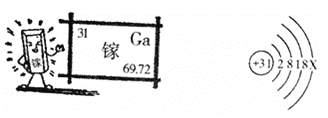
请阅读信息后回答:
(1)金属镓_____(填物理性质);
(2)镓原子结构示意图中X的数值______________;
(3)镓的氧化物的化学式______________;
(4)氮化镓(GaN)是第三代半导体材料,般采用GaCl3与NH3在一定条件下反应制得,同时得到另一种化合物。该反应的化学方程式为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“水是生命之源”,生活中我们常常接触雨水、河水和自来水等。
(1)若想检验河水是硬水还是软水,可用的物质是______________, 要除去河水样品中的色素和异味,可向河水样品中加入_______________。
(2)除去水中难溶杂质最常用的方法是___________, 此操作中需要使用玻璃棒,它的作用是_________。
(3)高铁酸钾(K2FeO4) 是一种新型自来水消毒剂,它在水中发生反应的化学方程式为:  ,则X的化学式为___________。
,则X的化学式为___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有一份氧元素质量分数为 89.5%的过氧化氢溶液,加入 MnO2 充分反应后,得到液体的 质量为 90g(不考虑操作过程中液体的损失),则生成氧气的质量为________________g(精确到小 数点后 1 位)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】美羊羊同学在购买回的袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色的,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3;灰白色粉末应该含有CaCO3和Fe;为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与。
[实验目的]证实灰白色粉末中含有CaCO3和Fe。
[实验设计]装置如下图所示:
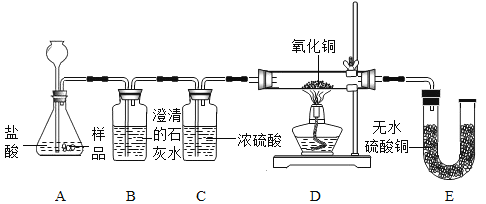
[实验预测与分析]
①若要证实样品中含有CaCO3,观察到的实验现象是______,B中发生反应的化学方程式为_____。
②若要证实样品中含有Fe,E中应观察到的现象是______,此时C装置的作用是_______。
③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐在生产和生活中具有广泛的用途。工业上常用电解饱和食盐水的方法制取烧碱,某化学兴趣小组为了探究久置的工业烧碱的成分,进行了如下实验:
(1)取少量样品于烧杯中,向其中加入过量稀盐酸,观察到有气泡产生,说明样品中含有____________________(填化学式) ,接着又向烧杯中继续加入硝酸银溶液,出现了白色沉淀,于是同学们得出结论:样品中____________________(填“一定"或“不一定” )含有氯化钠。
(2)除了需要确认是否含有氯化钠外,还需要确认样品中是否含有氢氧化钠。于是,大家又进行了下列实验:
①另取少量样品溶解于水,向其中加入过量硝酸钙溶液,产生白色沉淀,然后过滤、洗涤;
②取少量滤液滴入酚酞溶液,溶液变红;
③向滤液中加入足量稀硝酸,再滴入硝酸银溶液后产生白色沉淀。
由此判断,实验①中滤渣的成分是____________________(填化学式)。
(3)根据以上实验,得出的结论正确的是___________________(填字母)。
A.样品中无NaCl
B.样品中只有NaOH和Na2CO3
C.样品中无NaOH
D.样品中有Na2CO3、NaOH和NaCl
(4)该兴趣小组的同学通过查阅资料得知:电解饱和食盐水,除了生成烧碱以外,还生成了氢气和氯气。请写出该反应的化学方程式____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
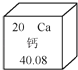
【题目】钙元素对人类生命和生活具有重要意义。
(1)在元素周期表中,钙元素的信息如图所示。钙元素的相对原子质量为_____。
(2)儿童缺钙可能会导致____(填“贫血症”或“佝偻病”)。
(3)氧化钙能与水反应,此反应可用于________(填字母序号)。
A.吸收水分 B.制熟石灰 C.加热食物
(4)熟石灰的化学式为________,它可用于制备补碘剂![]() ,其中碘元素的化学价为_______。
,其中碘元素的化学价为_______。
(5)“冰洲石”(主要成分为![]() )制成的工艺品不能与盐酸接触,用化学方程式表示其原因:________。
)制成的工艺品不能与盐酸接触,用化学方程式表示其原因:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com