
| A. | 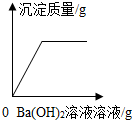 向H2SO4和CuSO4的混合溶液中滴加Ba(OH)2溶液 | |
| B. | 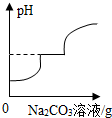 向HCl和CaCl2混合溶液中滴加Na2CO3溶液 | |
| C. | 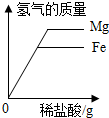 向等质量的Mg和Fe中滴加稀盐酸 | |
| D. | 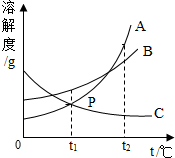 将t2℃时A、B、C的饱和溶液降温至t1℃时,其溶质质量分数大小关系为B>A=C |
分析 A、根据向H2SO4和CuSO4的混合溶液中滴加Ba(OH)2溶液,会立即产生硫酸钡的白色沉淀进行解答;
B、根据向HCl和CaCl2混合溶液中滴加Na2CO3溶液,碳酸钠要先与盐酸反应生成,所以溶液的酸性减弱,当盐酸反应完毕后碳酸钠再和氯化钙反应生成碳酸钙沉淀和氯化钠,此时溶液呈中性,当碳酸钠溶液过量时溶液呈碱性进行解答;
C、根据两者的金属活动性顺序的应用分析解答;
D、根据饱和溶液质量分数的计算并结合物质的溶解度变化考虑.
解答 解:A、向H2SO4和CuSO4的混合溶液中滴加Ba(OH)2溶液,会立即产生硫酸钡的白色沉淀,随着氢氧化钡溶液的不断加入,沉淀的质量不断增加,当反应完毕后沉淀不再变化,为一定值,故A正确;
B、向HCl和CaCl2混合溶液中滴加Na2CO3溶液,碳酸钠要先与盐酸反应生成,所以溶液的酸性减弱,当盐酸反应完毕后碳酸钠再和氯化钙反应生成碳酸钙沉淀和氯化钠,此时溶液呈中性,当碳酸钠溶液过量时溶液呈碱性,所以图象符合该过程,故B正确;
C、向等质量的Mg和Fe中滴加稀盐酸,开始产生氢气的质量一样,但是等质量的Mg和Fe完全 金属镁产生的氢气多,故C正确;
D、将t2℃时A、B、C三种物质溶解度由大到小是A>B>C,所以其饱和溶液的溶质质量分数由大到小的顺序为A>B>C,温度降温到t1℃时,A、B仍为饱和溶液,且B的溶解度大于A的溶解度,C为不饱和溶液,故三种溶液的溶质质量分数大小关系B>A>C,故D错误.
故选:D.
点评 根据曲线的纵横坐标轴的说明,判断曲线所表示的变化关系,此是正确答题的根本.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
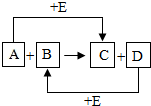 A、B、C、D、E 都是初中化学常见的物质,其中D是一种紫红色金属单质,它们之间的转化关系如图所示,反应条件均已略去.若A 是化合物,反应A+B→C+D 的化学方程式是CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+Cu.
A、B、C、D、E 都是初中化学常见的物质,其中D是一种紫红色金属单质,它们之间的转化关系如图所示,反应条件均已略去.若A 是化合物,反应A+B→C+D 的化学方程式是CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+Cu.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 40% | B. | 56% | C. | 88% | D. | 12% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com