


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:初中化学 来源: 题型:
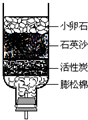 (2010?平谷区一模)水是人类生活中不可缺少的物质.
(2010?平谷区一模)水是人类生活中不可缺少的物质.
| ||
| ||
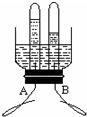
| ||
| ||
| 1.429g/L×1L |
| 0.089g/L×2L+1.429g/L×1L |
| 1.429g/L×1L |
| 0.089g/L×2L+1.429g/L×1L |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
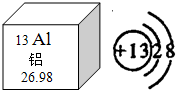 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
| ||
| ||
| ||
| ||
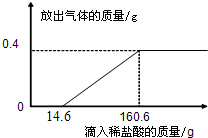
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%NaOH溶液,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有 铝 铝 . |
| ②取步骤①所得滤渣,加过量的 10%盐酸 10%盐酸 ,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 铁和铜 铁和铜 . |
查看答案和解析>>
科目:初中化学 来源:2013年四川省泸州市高级中等学校招生考试化学 题型:059
A、B、C、D为金属活动顺序表中常见的四种金属.已知:①A+BSO4=ASO4+B ②C+H2SO4=CSO4+H2↑ ③B+2DNO3=B(NO3)2+2D 请完成以下填空:
(1)金属C在金属活动顺序表中排在氢________(填“前面”或“后面”).
(2)根据上述反应能判断出其中三种金属的活动性,其金属活动性由强到弱的顺序是________(用字母填写).
(3)若A、B、C、D分别为锌、铁、铜、银中的一种,金属C与H2SO4反应后所得溶液呈浅绿色,则金属A为________,反应③的化学方程式为________.
查看答案和解析>>
科目:初中化学 来源:2013年初中毕业升学考试(贵州安顺卷)化学(解析版) 题型:推断题
如图所示:已知A是一种常见的金属单质,B是一种紫色固体单质.C是一种红色固体氧化物,D是一种黑色固体氧化物,E、F各表示一种化合物:A、C、D、E、F几种物质中均含有同种金属元素.请根据图示变化回答下列问题:
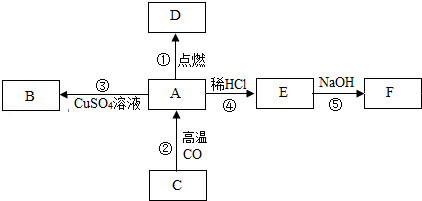
(1)写出D和E这两种物质的化学式: 、 .
(2)在如图所示的变化中,属于化合反应的是 (填反应序号,下同),属于复分解反应的是 ;
(3)写出反应②的化学方程式: .
查看答案和解析>>
科目:初中化学 来源:江苏期末题 题型:实验题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com