
 碘元素是人体必需的微量元素之一.
碘元素是人体必需的微量元素之一.分析 (1)根据元素周期表中的一个小格所提供的信息,其中原子序数=核外电子数=质子数=核电荷数,进行解答;
(2)①氯化钠是由钠元素和氯元素组成的化合物,化学式为NaCl;氯化钠含有的阴离子是Cl-;根据“在化合物中,正负化合价的代数和为零”的原则,解答KIO3中I的化合价;
②由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.
解答 解:(1)根据元素周期表中的一个小格所提供的信息,可知碘原子的核电荷数是 53,
(2)①氯化钠是由钠元素和氯元素组成的化合物,化学式为NaCl;氯化钠含有的阴离子是氯离子;表示为:Cl-;
根据“在化合物中,正负化合价的代数和为零”的原则,可得KIO3中I的化合价为:(+1)+x+(-2)×3=0;x=+5;
②由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式KIO3+5X+3H2SO4=3K2SO4+3I2+3H2O,反应前钾、碘、氧、氢、硫原子个数分别为1、1、15、6、3,反应后的生成物中钾、碘、氧、氢、硫原子个数分别为6、6、15、6、3,根据反应前后原子种类、数目不变,则5X分子中含有5个钾原子和5个碘原子,则每个X分子由1个钾原子和1个碘原子构成,则物质X的化学式为KI.
故答案为:(1)53;(2)①Cl-;+5价; ②KI.
点评 本题考查学生对化合价计算及根据物质中某元素的质量及质量分数计算方法的掌握与在解题中应用的能力.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
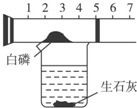 某同学用如图所示装置粗略地测定空气中氧气的体积分数.图中烧杯上方玻璃管(预先固定好)中部有一可滑动的活塞,活塞左端管内有密封的空气,活塞右端的玻璃管口跟空气连通,实验开始前活塞处在刻度为5cm处.(提示:生石灰与水反应放出大量的热,白磷是足量的)回答下列问题:
某同学用如图所示装置粗略地测定空气中氧气的体积分数.图中烧杯上方玻璃管(预先固定好)中部有一可滑动的活塞,活塞左端管内有密封的空气,活塞右端的玻璃管口跟空气连通,实验开始前活塞处在刻度为5cm处.(提示:生石灰与水反应放出大量的热,白磷是足量的)回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ”表示氢原子,用“
”表示氢原子,用“ ”表示碳原子,“
”表示碳原子,“ ”表示氧原子,写出下列粒子模型所对应的分子名称:
”表示氧原子,写出下列粒子模型所对应的分子名称: 氢分子 (2)
氢分子 (2) 两个氧原子
两个氧原子 水分子 (4)
水分子 (4) 甲烷分子.
甲烷分子.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
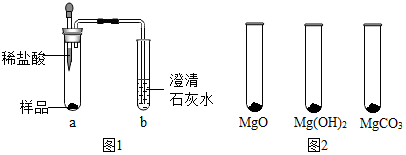
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com