
【题目】能源与环境成为人们日益关注的问题,它与人类的生活和社会发展密切相关。
(1)目前,人类以化石燃料为主要能源,常见的化石燃料包括煤、石油和_____;
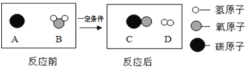
(2)为提高煤的利用率,在一定条件下可将其转化为可燃性气体,此过程的微观示意图如图所示:该反应的化学方程式为_____;
(3)近年来,我市农村大力推广使用沼气,沼气的主要成分是甲烷,写出甲烷燃烧的化学方程式_____。
科目:初中化学 来源: 题型:
【题目】某炼铁厂用赤铁矿石炼铁(除氧化铁外,其他成分不溶于水,也不与酸反应),现要测定该赤铁矿中氧化铁的含量,进行如下实验:

(1)写出上述发生反应的化学方程式_____;
(2)列出求解20g赤铁矿石中氧化铁质量(x)的比例式_____;
(3)此赤铁矿中氧化铁的质量分数为_____;
(4)向反应后所得溶液中加入46.5g水,则最终溶液中溶质的质量分数为_____;
(5)若用配制100g 21.9%的稀盐酸,则需要36.5%的浓盐酸的质量为_____g;配制稀盐酸时除了需要烧杯、量筒外,还需要的仪器有_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料与人类的生产和生活密切相关。请回答:
(1)铝通常被用于制作电线,这是利用了它的______性和______性
(2)工业上利用“铝热反应”焊接钢轨其原理是在高温下用铝将氧化铁中的铁置换出来。写出反应的化学方程式:______
(3)中国高铁制造处于世界先进水平,福建是全国第一个市市通高铁的省份。高铁建设需要大量的钢铁,高炉炼铁的主要原理是利用一氧化碳在高温下还原氧化铁,反应的化学方程式为______
(4)为了验证铝、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是______(填序号)
①将铝、银分别浸入到硫酸铜溶液中②将银分别浸入到硫酸铝、硫酸铜溶液中
③将铜、银分别浸入到硫酸铝溶液中④将铜分别浸入到硫酸铝、硝酸银溶液中
(5)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液。
①滤液中一定含有的溶质是______(填化学式);②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是______(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是验证质量守恒定律的实验。

(1)实验A中气球的作用是_____,实验结束后冷却至室温,气球比原来更瘪的原因是_____,此时将锥形瓶倒置于水中,取下气球,可观察到_____。
(2]实验B反应后天平的指针(填“偏左”、“偏右”、“不变”)_____,原因是_____,该反应是否符合质量守恒定律?_____(填“符合”、“不符合”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家曾用射电望远镜在星际云中发现了甲醛的气体,甲醛分子的模型如图所示,对该气体从宏观到微观进行分析时,其中正确的是( )

A. 甲醛可能是氧化物
B. 甲醛分子是由1个碳原子和1个水分子构成
C. 甲醛中碳、氢、氧三种元素的质量比为6:1:8
D. 甲醛气体是由C、H、O三种原子构成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为某化学反应的微观示意图,其中“○”和“●”表示两种不同元素的原子。该反应()

A. 是化合反应B. 可表示氢气和氧气的反应
C. 反应前后原子种类发生了变化D. 反应前后元素化合价没有发生变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:分别取5.0g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量,溶质质量分数为10%的氢氧化钠溶液,反应得到沉淀的实验数据如下表:
甲 | 乙 | 丙 | |
加入氢氧化钠溶液质量(g) | 35.0 | 40.0 | 45.0 |
反应得到沉淀的质量(g) | 2.5 | 2.9 | 2.9 |
试回答下列问题:
(1)上述实验中,_______同学所用的氢氧化钠溶液一定过量。
(2)计算乙同学实验后所得溶液中的氯化钠的质量分数______。(结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶段加入,溶液液的pH的变化如图所示。试回答:
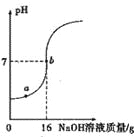
(1)a点溶液中含有的离子有____________________________。
(2)当pH=7时,消耗NaOH溶液中NaOH的质量为____________。
(3)计算稀H2SO4的溶质质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com