
| 实验步骤 | 实验现象 | 实验结论 |
| 实验步骤 | 实验现象 | 实验结论 |
| 向2只试管中分别加入1%和10%的氢氧化钠溶液,再分别滴加几滴酚酞试液. | 盛有1%的氢氧化钠溶液的试管中溶液始终为红色,另一支试管溶液立即变红,但一振荡红色又很快褪去. | 当氢氧化钠溶液的浓度大于10%时会与酚酞生成一种物质而使变红的酚酞发生褪色. |


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
| ||
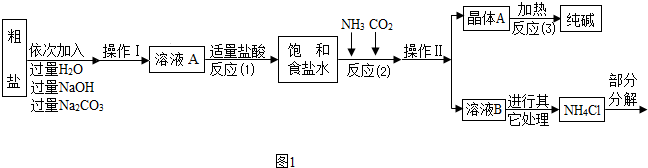
| 选择的装置 | 实验现象 | 实验结论 |
| 样品不含晶体A |

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是某药厂生产的葡萄糖注射液的标签.其溶质葡萄糖的化学式为C6H12O6,是计算:
如图是某药厂生产的葡萄糖注射液的标签.其溶质葡萄糖的化学式为C6H12O6,是计算:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 反应次数 | 稀盐酸的质量(g) | 混合物的质量(g) | 产生CO2的质量(g) |
| 1 | 100 | 27.6 | 6.6 |
| 2 | 100 | 36.8 | 8.8 |
| 3 | 100 | 39.0 | 8.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A | B | C | |
| 实验 装置 | 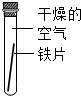 | 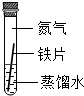 | 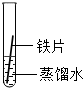 |
| 实验 现象 | 铁片不生锈 | 铁片不生锈 | 铁片生锈且水面 附近锈蚀最严重 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com