
| A. | 该气体中一定含有 C2H4 | |
| B. | 该气体中一定没有CH4 | |
| C. | 该气体中可能含有 C2H2 | |
| D. | 该气体不可能同时含有 CH4、C2H2、C2H4 |
分析 根据二氧化碳和水的质量比为22:9,可计算出碳、氢两种元素的质量比,据此解答.
解答 解:生成的二氧化碳和水的质量比为22:9,则碳元素和氢元素的质量比为:(22×$\frac{12}{44}$):(9×$\frac{2}{18}$)=6:1,故碳氢原子的个数比为:$\frac{6}{12}:\frac{1}{1}$=1:2,
A.若是含一个CH4和一个C2H2,则能达到碳氢原子个数比是1:2,该气体中不一定含有C2H4,错误;
B.若是含一个CH4和一个C2H2,则能达到碳氢原子个数比是1:2,错误;
C.该气体中可能含有C2H2,正确;
D.该气体可能同时含有CH4、C2H2、C2H4,错误;
故填C.
点评 根据化学式进行有关的推断时,要结合质量守恒定律以及化学式的有关计算进行.


科目:初中化学 来源: 题型:选择题
| A. | 打开盛有浓盐酸的试剂瓶,在瓶口出现白雾 | |
| B. | 将镁条放入稀硫酸中,有气泡产生 | |
| C. | 向氢氧化钠溶液中滴加紫色石蕊溶液,溶液变红 | |
| D. | 铁在氧气中燃烧的现象为剧烈燃烧,火星四射,放出热量,生成黑色物质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 4P+5O2↑=2P2O5 | B. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | Cu+AgNO3=CuNO3+Ag |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 海水“晒盐”得到的粗盐中往往含有可溶性杂质(MgCl2、CaCl2、Na2SO4等)和不溶性杂质(泥沙等).某化学兴趣小组应用所学知识除去粗盐中主要杂质而得到精盐.其主要操作过程如下:
海水“晒盐”得到的粗盐中往往含有可溶性杂质(MgCl2、CaCl2、Na2SO4等)和不溶性杂质(泥沙等).某化学兴趣小组应用所学知识除去粗盐中主要杂质而得到精盐.其主要操作过程如下:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 天然气泄漏,立即关闭阀门并开窗通风 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 据《自然》杂志报道,科学家最近研制出一种以锶做钟摆的钟,它是世界上最精确的钟.锶原子结构示意图和在元素周期表中显示的信息如图所示:
据《自然》杂志报道,科学家最近研制出一种以锶做钟摆的钟,它是世界上最精确的钟.锶原子结构示意图和在元素周期表中显示的信息如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
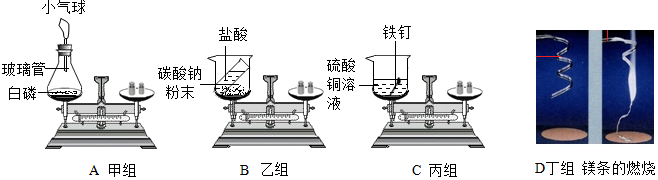
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com