
【题目】二氧化氯(ClO2)可用于自来水消毒.以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②特殊条件下电解NaCl溶液制NaClO3;③ClO2的制取.工艺流程如图,其中反应Ⅲ制取ClO2的化学方程式为2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O。
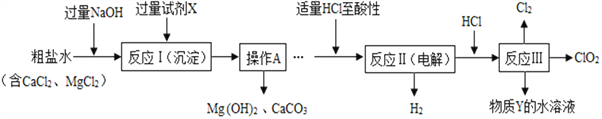
(1)试剂X是___________(填化学式)。
(2)操作A中用到玻璃棒的作用是_____________。
(3)加入适量HCl至酸性过程中,发生的中和反应的化学方程式是___________。
(4)写出反应II的化学方程式___________________________。
(5)该流程中可以循环利用的物质是水和_______________。
【答案】 Na2CO3 引流 NaOH+HCl= NaCl +H2O NaCl+3H2O![]() NaClO3+3H2↑ NaCl
NaClO3+3H2↑ NaCl
【解析】本题以工业上用NaCl还原NaClO3生产ClO2的工艺流程考查混合物的分离、提纯,明确流程是解答本题的关键。
(1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,所以加入过量氢氧化钠的目的是除尽粗盐水中MgCl2,碳酸钠和氯化钙反应会生成碳酸钙沉淀和氯化钠,所以过量的试剂X是Na2CO3;
(2)操作A是除去液体中的不溶性固体的操作,也就是过滤,过滤操作中,玻璃棒的作用是引流;
(3)氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(4)特殊条件下电解NaCl溶液制NaClO3和氢气,化学方程式为:NaCl+3H2O![]() NaClO3+3H2↑;
NaClO3+3H2↑;
(5)既是反应物,也是生成物的物质可以循环使用,通过分析反应流程可知,该流程中可循环利用的物质是水和氯化钠。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:初中化学 来源: 题型:
【题目】某同学取一块石灰石样品(成分为碳酸钙及20%的不含钙的杂质,杂质不溶于水且不与酸反应)研碎后忘记称量而直接煅烧一定时间后,称量剩余固体的质量为103g,向其加入质量分数为14.6%的稀盐酸发现有气泡产生,恰好完全反应后共用去500g稀盐酸,则已分解的碳酸钙质量占原样品质量的质量分数为
A. 40% B. 50% C. 60% D. 80%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】M、N两种物质的溶解度曲线如图所示。t2℃时,分别将50 g的M、N固体加入到100 g水中,搅拌。下列说法不正确的是( )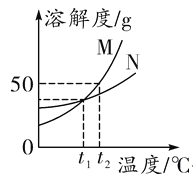
A. t2 ℃时,N固体不能完全溶解
B. t2 ℃时,M的饱和溶液中溶质的质量分数为50%
C. M的溶解度受温度变化的影响大于N
D. 分别将上述t2 ℃时 M、N的溶液降温到t1 ℃,得到M、N溶液的质量一定相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气中氮气的含量最多,氮气在一定条件下可与某些物质发生反应。下图是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程。下列说法不正确的是
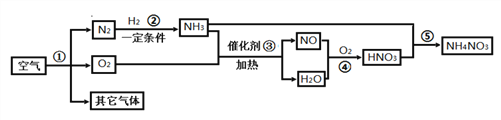
A. 步骤①中发生的是物理变化
B. 上述物质中氮元素的化合价有3种
C. 上述化学反应中属于化合反应的有②④⑤
D. 施用硝酸铵这类肥料时,要避免与碱性物质混合使用
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁是一种白色的粉末,其外观、物理性质与氧化镁相似。过氧化镁在常温下比较稳定,但是加热时会分解生成氧气和氧化镁。写出该反应的化学方程式____________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2 。同时温度升高,说明该反应_____热量(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁【Mg2( OH)2CO3】和30%的过氧化氢溶液来制取过氧化镁。
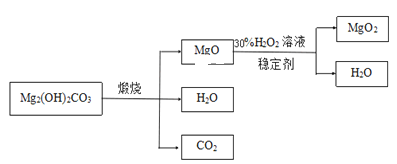
【资料】①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳;
②氧化镁与过氧化氢反应放出大量的热。
(3)检测煅烧过程碱式碳酸镁已完全分解的方法是_________________(写出具体的操作和现象);上述生产过程加入稳定剂的作用是__________________。
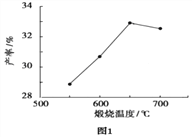
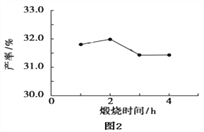
(4)用上述碱式碳酸镁在 550、600、650 及 700 ℃ 下煅烧一定的时间生成氧化镁,再用上述条件制备的氧化镁分别与 30% 双氧水反应生成过氧化镁的产率如下面的图1和图2。碱式碳酸镁煅烧的温度适宜控制在_______℃,煅烧的时间适宜控制在______h。
三.过氧化镁的纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。
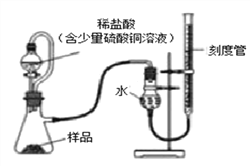
①装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管读数为10.0mL。
②打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
③再次调节刻度管使左右两边液面相平,刻度管读数为122mL。
(5)实验步骤中,装入药品前应先(_________)。
(6)稀盐酸中放入少量硫酸铜溶液的目的是______________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数(写出具体的计算过程,该实验条件下O2密度为1.429g/L)。 ____________
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A.生成的氧气有少量溶于水 B.未等装置冷却到室温就开始读数
C.杂质与盐酸反应能产生少量的气体 D.滴入的稀盐酸占了一部分气体的体积
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活密切相关。请回答以下问题:
① 活性炭可去除冰箱中异味,利用活性炭的______性。
② 土壤里撒入适量的石灰,使土壤的______(填“酸性”或“碱性”)减弱。
③ 金属冶炼可使矿石中金属元素转变为______(填“化合”或“游离”)态。 写出氢气还原氧化铜的化学方程式________。
④ 自来水生产中通入氯气的作用是______;实验室制取氯气的化学方程式是
4HCl(浓) + MnO2![]() X + Cl2↑+ 2H2O ,则 X 的化学式为______。
X + Cl2↑+ 2H2O ,则 X 的化学式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列问题的研究中,未利用对比实验思想方法的是( )
A.  研究空气中氧气含量
研究空气中氧气含量
B. 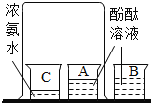 研究分子的运动
研究分子的运动
C. 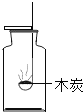 研究木炭在氧气中燃烧
研究木炭在氧气中燃烧
D.  研究二氧化碳与水的反应
研究二氧化碳与水的反应
查看答案和解析>>
科目:初中化学 来源: 题型:
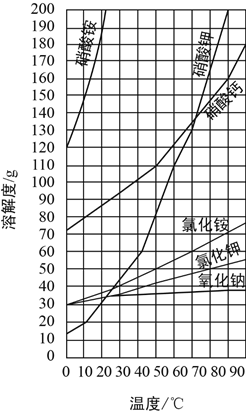
【题目】一些物质的溶解度同线如图,回答下列问题:
(1)70℃时,在100g水中加入110g硝酸钾固体,所形成的溶液是__________溶液(填“饱和”或“不饱和”)。
(2)将上述溶液降温到10℃时,析出的晶体质量是__________g。
(3)工业上将硝酸钾和氯化钠的热混合溶液(两者均已达饱和)冷却至室温,析出晶体。
①析出的晶体含有的物质是____________________(填化学式)。
②关于剩余溶液,下列说法正确的是__________。
A.只含有氯化钠,不含硝酸钾,且氯化钠达到饱和
B.含有氯化钠,又含有硝酸钾,且只有氯化钠达到饱和
C.含有氯化钠,又含有硝酸钾,且两者都达到饱和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com