
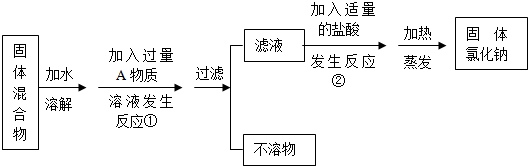
分析 氯化钙能和碳酸钠反应生成白色沉淀碳酸钙和氯化钠;
碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
盐酸易挥发,加热含有盐酸的氯化钠溶液时,随着水的蒸发,氯化氢气体也随着挥发,当水完全蒸发后,氯化氢也完全挥发.
解答 解:(1)氯化钠和氯化钙的混合溶液中,加入碳酸钠时,氯化钠不能和碳酸钠反应,氯化钙能和碳酸钠反应,因此利用碳酸钠可以除去溶液中的氯化钙,即加入的A是碳酸钠,碳酸钠的化学式是Na2CO3;
氯化钙能和碳酸钠反应生成白色沉淀碳酸钙和氯化钠,反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl.
故填:Na2CO3;Na2CO3+CaCl2═CaCO3↓+2NaCl.
(2)碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳,因此加入稀盐酸能够除去过量的碳酸钠,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
故填:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(3)由于盐酸易挥发,反应②中如果加入的盐酸也过量,随着水的蒸发,氯化氢气体也随着挥发,当水完全蒸发后,氯化氢也完全挥发,因此对所得到的氯化钠的纯度没有影响.
故填:没有.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:选择题
| A. | 用托盘天平称取2.5g锌 | B. | 用量筒量取5.29mL盐酸 | ||
| C. | 用pH试纸测得某溶液的pH是5.4 | D. | 用托盘天平称取2.542g食盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2SO4、MgO、NaOH | B. | H2O、Ca(OH)2、HCl | ||
| C. | H2SO4、NaOH、Al2O3 | D. | KOH、HNO3、CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com