
分析 根据金属与盐的反应规律,利用Mn、Fe、Mg、Cu四种金属及其化合物间可发生的反应,推断Mn、Fe、Mg、Cu四种金属活动性由强至弱的顺序.
解答 解:①铁与硫酸铜反应生成铜和硫酸亚铁,化学方程式为:Fe+CuSO4=FeSO4+Cu;
②根据A.Fe 和CuSO4 溶液反应,说明铁的活动性比铜强;B.Mg和MnSO4 溶液反应,说明镁的活动性比锰强; C.Mn和FeSO4 溶液反应,说明锰的活动性比铁强;则Mn、Fe、Mg、Cu四种金属活动性由强至弱的顺序为Mg>Mn>Fe>Cu.
故答案为:①Fe+CuSO4=FeSO4+Cu;②Mg>Mn>Fe>Cu.
点评 在金属活动性顺序中,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 8g | B. | 24g | C. | 12g | D. | 16g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | a+m+n | B. | a-m-n | C. | m+n-a | D. | m-n-a |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
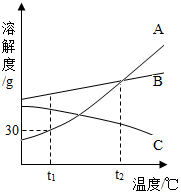 如图是A、B、C三种物质的溶解度曲线,据图回答:
如图是A、B、C三种物质的溶解度曲线,据图回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com