
【题目】洁厕灵、84消毒液是两种常见的清洁、消毒用品,混合使用时会发生如图反应:

下列说法正确的是( )
A. 该反应是分解反应
B. 有毒气体是Cl2
C. 反应前后元素化合价不变
D. 84消毒液、洁厕灵能混合使用
【答案】B
【解析】
A、由多种物质反应生成一种物质的反应叫作分解反应,该反应是由两种物质反应生成三种物质,不属于分解反应,错误;B、根据质量守恒定律,反应前后原子的种类和数目不变,反应前氢原子的个数为2,氯原子的个数为3,钠原子的个数为1,氧原子的个数为1,反应后氢原子的个数为2,氯原子的个数为1,钠原子的个数为1,氧原子的个数为1,所以有毒气体是Cl2,正确;C、反应前HCl中氯元素的化合价为-1价,NaClO中氯元素的化合价为+1价,反应后Cl2中氯元素的化合价为0,所以反应前后有元素的化合价发生了改变,错误;D、84消毒液、洁厕灵能混合会产生有毒气体,不能混用,错误。故选B。


科目:初中化学 来源: 题型:
【题目】回答下列与含碳物质有关的问题。
![]() 普通干电池采用石墨作为电极材料,是利用其优良的______性。
普通干电池采用石墨作为电极材料,是利用其优良的______性。
![]() 金刚石、石墨和
金刚石、石墨和![]() 组成元素相同,物理性质差异较大的原因是______。
组成元素相同,物理性质差异较大的原因是______。
![]() 高炉炼铁的主要反应为Fe2O3+3CO
高炉炼铁的主要反应为Fe2O3+3CO ![]() 2Fe+3CO2,发生氧化反应的物质是______。
2Fe+3CO2,发生氧化反应的物质是______。
![]() 实验室检验
实验室检验![]() 时,常选择的试剂是______。
时,常选择的试剂是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】日常生活中所说的盐,通常指食盐(主要成分是氯化钠)。
(1) 通过晾晒海水,可以蒸发除去水分,得到粗盐。通常不采用降低海水温度的方法得到粗盐,是因为_____________,相同情况下降温析出的晶体比较少。
(2)根据“粗盐中难溶性杂质的去除”实验,回答有关问题。
①溶解 称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.1g。
②过滤
③蒸发 在加热过程中,用玻璃棒不断搅拌,防止_______。当蒸发皿中___,停止加热。
④计算产率 得到精盐3.3g,则精盐的产率为__________(计算结果保留一位小数)。
(3)若经过上述实验得到的精盐中还含有氯化镁、氯化钙,为了除去这两种可溶性杂质,可将得到的精盐全部溶于水,加入过量的氢氧化钠溶液和__________溶液,充分反应后,接下来的操作顺序是__________(填序号)。
①蒸发 ②加入过量的稀盐酸 ③过滤
查看答案和解析>>
科目:初中化学 来源: 题型:
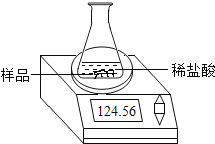
【题目】某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验。实验装置如图所示:称取研细的2.50g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止。测得反应前后的有关质量如表:
(1)反应生成二氧化碳的质量为_____。
(2)计算石灰石样品中CaCO3的质量分数_____。
(3)若在上述实验过程中石灰石样品和所加酸液均无抛洒,根据图中装置判断,该实验结果可能_____(填“偏大”、“偏小”或“准确”)。
反应前,整套装置+样品的质量/g | 共加入:稀盐 酸的质量/g | 反应后,整套装置+锥 形瓶中剩余物的质量/g |
104.60 | 20.00 | 123.72 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属钛(Ti)的合金具有耐高温,耐腐蚀、强度高等性能,所以,钛合金广泛用于航空、航天工业及化学工业.工业上冶炼金属钛的过程是以钛矿石(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氯气为原料,在高温条件下制取TiCl4,其反应化学方程式为:2FeTiO3+6C+7Cl2![]() 2TiCl4+2X+6CO,然后用镁与TiCl4在高温条件下反应生成金属钛和氯化镁.请根据以上信息回答下列问题:
2TiCl4+2X+6CO,然后用镁与TiCl4在高温条件下反应生成金属钛和氯化镁.请根据以上信息回答下列问题:
(1)FeTiO3中钛元素的化合价为 价.
(2)在制备TiCl4的反应中,X的化学式为 .
(3)镁与TiCl4反应的化学方程式为: .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图①表示向稀盐酸中不断加水
B. 图②表示探究过氧化氢制氧气的反应中二氧化锰的作用
C. 图③表示向氢氧化钙溶液中通入含有少量氯化氢的二氧化碳气体
D. 图④表示20℃时,向一定量的接近饱和的硝酸钾溶液中加入硝酸钾固体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组的同学取铜锌合金的粉末10g于烧杯中,向其中加入一定量的稀盐酸后,恰好完全反应,过滤后,得滤液的质量为272g,其溶质的质量分数为5%.请回答下列问题:
(1)铜锌合金中铜的质量.
(2)所用稀盐酸中溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组对铁制品锈蚀相关问题进行探究。

实验一:探究氧气浓度对铁制品锈蚀的影响
(1)仪器a的名称为______。
(2)写出实验室用高锰酸钾制取氧气的化学方程式:______,发生装置应选______(填装置编号)。
(3)收集氧气浓度不同的混合气体(含氮气和氧气),可选用的装置是______(填装置编号)。
(4)设计实验探究氧气浓度对铁制品锈蚀快慢的影响。请简述实验方案(操作步骤、需控制的变量、应观察的现象,可结合图示说明) ___________。
实验二:探究铁锈的成分
若铁锈成分为FexOy·nH2O,用下图所示装置(夹持仪器己省略)进行实验(每步反应和吸收均完全)。FexOy·nH2O受热容易分解产生水蒸气。无水硫酸铜能吸收水而变蓝,碱石灰既能吸收水也能吸收CO2。

(5)指出上图所示实验装置的一个明显缺陷 ______。
(6)加热前,先通CO气体一段时间,目的是______。
(7)为确定铁锈组成,将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,实验过程测得以下数据(忽略玻璃管中残留水蒸气):
铁锈样品的质量/g | 装置A的质量(不包括喷灯)/g | 装置B的质量/g | |
反应前 | 23.2 | 258.1 | 232.4 |
反应后 | 246.1 | 239.6 |
根据以上数据计算该铁锈样品中Fe元素质量为_____g,n的值为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com