
| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
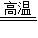 CaO+CO2↑
CaO+CO2↑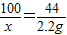
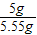 ×100%≈90.1%;
×100%≈90.1%;

科目:初中化学 来源: 题型:
| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
查看答案和解析>>
科目:初中化学 来源:化学教研室 题型:038
|
操作次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
剩余固体质量(g) |
4.25 |
3.95 |
3.35 |
3.35 |
请计算:
(1)完全反应后生成二氧化碳 g
(2)求汉白玉中碳酸钙的质量分数。
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
查看答案和解析>>
科目:初中化学 来源:2011-2012学年湖北省黄冈市浠水县英才学校九年级(上)第二次月考化学试卷(解析版) 题型:解答题
| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com