
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
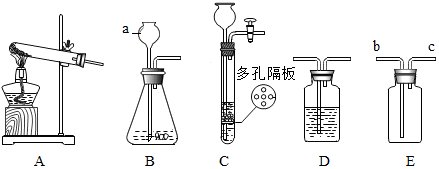
分析 【设计探究】金属与酸的反应为置换反应,写出反应的化学方程式;根据现象得出结论;
得出结论:根据金属的活动性顺序,分析金属的活动性与反应的剧烈程度的关系;
实验(2)根据注射器的作用是量取生成气体的体积解答;
得出结论:根据表中信息结合浓度对反应的影响分析解答;
【反思评价】根据表中信反应的剧烈程度与酸的浓度有关,结合反应的过程进行分析;
根据控制变量法结合影响反应速率的因素进行设计实验.
解答 解:【设计探究】由题意知:反应物、生成物,根据质量守恒定律,正确书写化学方程式,锌与盐酸反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑;
放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,因此金属活动性强弱为:Zn>Fe;
得出结论:金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈);
实验(2)注射器的作用是通过注射器往右移动的体积判断生成氢气的体积;
得出结论:根据表格信息可知,其他条件相同时,盐酸浓度越大,反应越剧烈;
【反思评价】锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进行,盐酸不断被消耗,浓度降低,产生气体速度变慢;
金属与盐酸反应的剧烈程度可能受温度、金属的颗粒大小、金属的纯度等因素的影响;可以利用控制变量法设计实验为:分别取等质量的锌片和锌粉于试管中,分别加入等体积等浓度的稀盐酸,观察产生气泡的快慢.(假设与方案要对应合理即可);
故答案为:实验(1):Zn+2HCl=ZnCl2+H2↑;>;金属活动性越强,反应越剧烈;
实验(2):通过注射器往右移动的体积测得生成氢气的体积;
其他条件相同时,盐酸浓度越大,反应越剧烈;
【反思评价】原因:锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢;
【假设】金属与盐酸反应的剧烈程度与金属表面积大小有关
【实验方案】分别取等质量的锌片和锌粉于试管中,分别加入等体积等浓度的稀盐酸,观察产生气泡的快慢.(假设与方案要对应合理即可)
点评 本考点主要考查了影响金属与酸发生化学反应速率的因素的探究,从酸的浓度、金属的活动性和金属的状态等不同的角度,设计实验,也考查了学生的实验设计能力.


科目:初中化学 来源: 题型:选择题
| A. | a、b、c可能分别为H3Z、HX、H2Y | B. | a、b、c可能分别为H2Y、H3Z、HX | ||
| C. | a、b、c可能分别为 HX、H3Z、H2Y | D. | a、b、c•可能分别为 H2Y、HX、H3Z |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
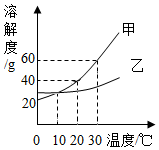 如图是甲、乙两种固体物质的溶解度曲线,下列说法不正确的是( )
如图是甲、乙两种固体物质的溶解度曲线,下列说法不正确的是( )| A. | 甲、乙物质都是易溶物 | |
| B. | 可用结晶的方法分离甲、乙的混合物 | |
| C. | 甲的饱和溶液从30℃降温至10℃后仍然饱和 | |
| D. | 10℃时,甲、乙的饱和溶液中所含溶质质量一定相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
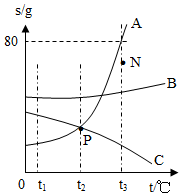 如图是A.B.C三种物质的溶解度曲线
如图是A.B.C三种物质的溶解度曲线查看答案和解析>>
科目:初中化学 来源: 题型:填空题
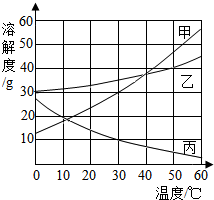 甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题:
甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com