
分析 根据氢氧化钠的物理性质与化学性质进行分析必须密封保存的原因;氢氧化钠溶液变质后生成的杂质是碳酸钠,因此检验是否变质即检验是否存在碳酸根离子
解答 解:氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水,因此氢氧化钠溶液必须密封保存;
氢氧化钠溶液变质后生成的杂质是碳酸钠,检验是否变质即检验是否存在碳酸根离子,稀盐酸能与碳酸钠溶液反应生成气体,与氢氧化钠溶液反应无明显现象,故根据是否产生气泡能用来检验氢氧化钠是否变质.
故答案为:氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水;
实验方法:检验CO32-的存在,取样品少许放在试管中,向样品中滴加稀盐酸,观察现象.
实验现象:若样品中有气泡产成,证明样品已变质.
有关化学方程式:2NaOH+CO2=Na2CO3+H2O.
点评 本题难度不大,考查氢氧化钠的性质、碳酸盐的检验方法,掌握氢氧化钠的性质、碳酸盐的检验方法是正确解答本题的关键.


科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①④⑤ | C. | ④①③④ | D. | ②②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | B. | Zn+H2SO4═ZnSO4+H2↑ | ||
| C. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25 | 28.5 | 33.3 | 40 | 55 | 75.4 |


查看答案和解析>>
科目:初中化学 来源: 题型:解答题
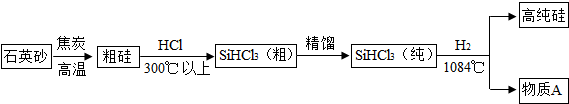
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
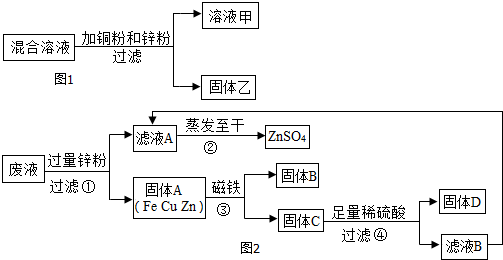
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
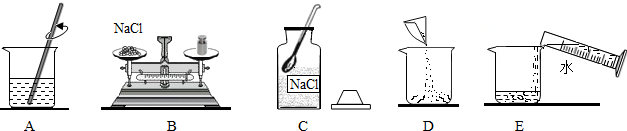
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com