
 2CuO+H2O+CO2↑,CuO+H2SO4=CuSO4+H2O
2CuO+H2O+CO2↑,CuO+H2SO4=CuSO4+H2O 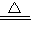 2CuO.
2CuO.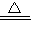 2CuO+H2O+CO2↑.
2CuO+H2O+CO2↑. 2CuO
2CuO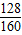 =
=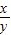 ,y=
,y=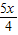
 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑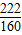 =
=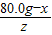 ,z=
,z=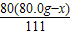
 +
+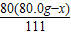 =80.0g
=80.0g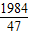 g
g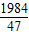 g=
g= g
g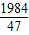 g:
g: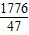 g=124:111
g=124:111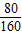 =
=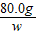 ,w=160g
,w=160g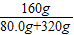 ×100%=40%
×100%=40%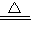 2CuO,Cu2(OH)2CO3
2CuO,Cu2(OH)2CO3 2CuO+H2O+CO2↑,CuO+H2SO4=CuSO4+H2O.
2CuO+H2O+CO2↑,CuO+H2SO4=CuSO4+H2O.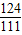 .
.

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 某同学在学习化学之后,对化学实验产生了浓厚兴趣,经常在家中完成一些家庭小实验.今天,他准备自己在家中完成一个自制“软壳蛋”的实验,有关他的实验不正确的是( )
某同学在学习化学之后,对化学实验产生了浓厚兴趣,经常在家中完成一些家庭小实验.今天,他准备自己在家中完成一个自制“软壳蛋”的实验,有关他的实验不正确的是( )查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com