
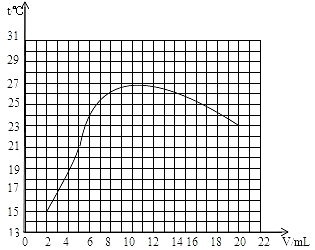
| 加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度上升(t)/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |

| 实验方法 | 可能观察到的现象 | 结论 |

| 实验验方法 | 可能观察到的现象 | 结论 |
| 从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加碳酸钠溶液 | 1、有气泡产生 2、无气泡产生 | 1、不是恰好完全反应 2、恰好完全反应 |
| 实验验方法 | 可能观察到的现象 | 结论 |
| 从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加碳酸钠溶液 | 1、有气泡产生 2、无气泡产生 | 1、不是恰好完全反应 2、恰好完全反应 |


科目:初中化学 来源: 题型:
| 加入盐酸积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:同步题 题型:填空题


查看答案和解析>>
科目:初中化学 来源:2006年江苏省南京市玄武区中考化学二模试卷(解析版) 题型:解答题
| 加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度上升(t)/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |

| 实验方法 | 可能观察到的现象 | 结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com