部分被氧化的铁片10g与200g的稀硫酸恰好完全反应,产生氢气0.3g,求该该硫酸溶液的溶质质量分数?
【答案】
分析:①根据Fe与H
2SO
4反应的化学方程式和生成氢气的质量,计算出参与反应的铁的质量和参与反应的H
2SO
4的质量,10g-参与反应的铁的质量=Fe
2O
3的质量;
②根据Fe
2O
3与H
2SO
4反应的化学方程式和①中计算出的Fe
2O
3的质量,即可计算出与Fe
2O
3反应的H
2SO
4的质量.
③两次反应的H
2SO
4的质量之和就是该硫酸溶液的溶质质量,然后根据溶质质量分数公式计算即可.
解答:解:①设参与反应的铁的质量为x,参与反应的H
2SO
4的质量为y,
Fe+H
2SO
4=FeSO
4+H
2↑
56 98 2
x y 0.3g
∴56:2=x:0.3g,98:2=y:0.3g,
解之得:x=8.4g,y=14.7g,
则Fe
2O
3的质量为10g-8.4g=1.6g;
②设与Fe
2O
3反应的H
2SO
4的质量为z,
Fe
2O
3+3H
2SO
4=Fe
2(SO
4)
3+3H
2O
160 294
1.6g z
∴160:294=1.6g:z,
解之得:z=2.94g,
③该该硫酸溶液的溶质质量分数=
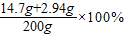
≈8.8%.
故答案为:8.8%.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.

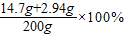 ≈8.8%.
≈8.8%.
