
| 金属种类 | 锰(Mn) | 镁 | 铁 |
| 与盐酸反应 | 略慢 | 快 | 很慢 |
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) | 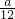 | 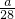 | 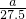 |
| 找到的规律 | ______ | ||


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:初中化学 来源: 题型:

 上述三种金属的活动性由弱到强的顺序是
上述三种金属的活动性由弱到强的顺序是
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属种类 | 锰(Mn) | 镁 | 铁 |
| 与盐酸反应 | 略慢 | 快 | 很慢 |
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 | ||||||
| 金属的相对原子质量 | 24 | 56 | 55 | ||||||
| 产生氢气的质量(g) |
|
|
| ||||||
| 找到的规律 | 相同质量的同价态的不同金属,与足量的酸反应,相对原子质量越大,生成氢气质量越小;反之亦然 相同质量的同价态的不同金属,与足量的酸反应,相对原子质量越大,生成氢气质量越小;反之亦然 | ||||||||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属种类 | 锰 | 镁 | 铜 |
| 与盐酸反应 | 略慢 | 快 | 无明显现象 |
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | |||
| 产生氢气的质量(g) | |||
| 找到的规律 | |||
查看答案和解析>>
科目:初中化学 来源:2012年山东省德州市乐陵市中考化学一模试卷(解析版) 题型:填空题
| 金属种类 | 锰(Mn) | 镁 | 铁 |
| 与盐酸反应 | 略慢 | 快 | 很慢 |
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) |  |  | 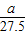 |
| 找到的规律 | |||
查看答案和解析>>
科目:初中化学 来源:2010年北京市宣武区中考化学二模试卷(解析版) 题型:填空题
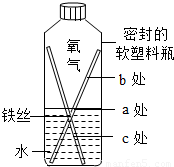
| 金属种类 | 锰(Mn) | 镁 | 铜 |
| 与盐酸反应 | 略慢 | 快 | 无明显现象 |
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) | a/12 | a/28 | a/27.5 |
| 找到的规律 | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com