
(8分)“化学就在我们身边,与我们的生活息息相关。请回答以下生活中的问题:
(1)家用天然气(或液化气)中常添加一种具有特殊气味的物质乙硫醇。当闻到该气味时,提醒人注意天然气(或液化气)已经在泄露。能闻到乙硫醇的气味,这证实了分子________________的性质。
(2)“沙里淘金”说明黄金在自然界中能够以 (填“单质”或“化合物”)形式存在。
(3)通常所说的煤气中毒是指由 (填物质化学式)引起的中毒。
(4)长期使用的暖水瓶内胆常有一层水垢(主要成分为CaCO3、Mg(OH)2),可以用厨房中的 调料除去。
(5)误食重金属盐(如:CuSO4、BaCl2等)可通过喝大量豆浆的方法解毒。你认为饮用下列 物质也可以达到同样的目的(填字母)。
A、牛奶 B、果汁 C、蛋清 D、矿泉水 E、食盐水
 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:阅读理解
 铁、铝、铜是日常生活中使用最广泛的金属.
铁、铝、铜是日常生活中使用最广泛的金属.| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g?cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
| ||
| ||
| ||
| ||
| ||
| 64×2 |
| 64×2+32 |
| 64×2 |
| 64×2+32 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
(11分)铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是____
(填序号)。
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g·cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
分析上述数据,碎石用的大锤常用铁制而不用铝制,原因是
_________________________________________________________。
(3)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
⑴金属的位置越靠前它的活动性就越强;
⑵位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
⑶位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为 ,由此我发现了一条新的判断依据 。
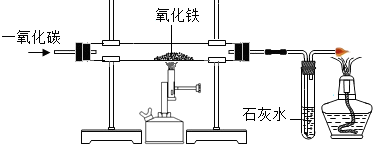
 (4)炼铁的原理是利用一氧化碳与氧
(4)炼铁的原理是利用一氧化碳与氧
化铁反应。在实验室里,可用右图
所示装置进行实验:实验中玻璃管内
的粉末由红色变为 色,该反
应的化学方程式为 ,通过实
验我可以得出的一氧化碳的相关
化学性质是 。
(5)工业上火法炼铜的一个主要反应是 Cu2S+ O2  2Cu+ SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。
2Cu+ SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。
用500吨含Cu2S 80%的铜矿石,理论上可以炼出多少吨铜?(请写出详细的计算过程,分步给分,计算结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g·cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
 2Cu + SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。
2Cu + SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。查看答案和解析>>
科目:初中化学 来源:2012届江苏省南京市第六中学九年级上学期期末考试化学试卷 题型:填空题
(11分)铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是____
(填序号)。
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g·cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
 2Cu + SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。
2Cu + SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省南京市九年级上学期期末考试化学试卷 题型:填空题
(11分)铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是____
(填序号)。
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
|
金属单质 |
铜 |
铝 |
锌 |
铁 |
铅 |
|
导电性(以银的导电性为100作标准) |
99 |
61 |
27 |
17 |
7.9 |
|
密度/(g·cm-3) |
8.92 |
2.70 |
7.14 |
7.86 |
11.3 |
|
熔点/℃ |
1083 |
660 |
419 |
1535 |
328 |
|
硬度(以金刚石的硬度为10作标准) |
2.5~3 |
2~2.9 |
2.5 |
4~5 |
1.5 |
分析上述数据,碎石用的大锤常用铁制而不用铝制,原因是
_________________________________________________________。
(3)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
⑴金属的位置越靠前它的活动性就越强;
⑵位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
⑶位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为 ,由此我发现了一条新的判断依据 。
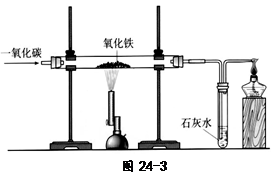
 (4)炼铁的原理是利用一氧化碳与氧
(4)炼铁的原理是利用一氧化碳与氧
化铁反应。在实验室里,可用右图
所示装置进行实验:实验中玻璃管内
的粉末由红色变为 色,该反
应的化学方程式为 ,通过实
验我可以得出的一氧化碳的相关
化学性质是 。
(5)工业上火法炼铜的一个主要反应是 Cu2S
+ O2  2Cu
+ SO2 Cu2S中铜元素的质量分数为_______________
(写出算式)。
2Cu
+ SO2 Cu2S中铜元素的质量分数为_______________
(写出算式)。
用500吨含Cu2S 80%的铜矿石,理论上可以炼出多少吨铜?(请写出详细的计算过程,分步给分,计算结果保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com