
在分别盛有铁片、铜片、锌片、镁片的试管中,都加入稀硫酸,产生气体最快的是(1)_________,最慢的是(2)______.不产生气体的是(3) _________.(均填元素名称)
科目:初中化学 来源: 题型:阅读理解
| 金属 | 空气 | 稀硫酸 | 硝酸银溶液 |
| 铁 | - | √ | √ |
| 铜 | - | - | √ |
| 镁 | √ | √ | √ |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 序号 | 步骤Ⅰ | 步骤Ⅱ | |||
| 实验 操作 |
将铁片、铜片和银片分别放入盛有溶质质量分数相同、体积相同的稀硫酸的试管中 | 将铁片分别放入盛有溶质质量分数相同、体积相同的CuSO4溶液和AgNO3溶液的试管中 | |||
 |
 |
 |
 |
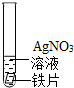 | |
| A | B | C | D | E | |
| 实验操作步骤 | 实验现象 | 结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
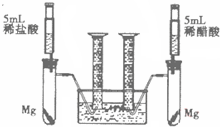 某校化学兴趣小组对金属活动性顺序等知识进行了研究.
某校化学兴趣小组对金属活动性顺序等知识进行了研究.

查看答案和解析>>
科目:初中化学 来源: 题型:
某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动顺序,设计了四种方案,你认为不可行的是( )
A.在两支试管中各装入少许CuSO4溶液,分别加入铁片和银片
B.在两支试管中各装入少许FeSO4溶液,分别加入铜片和银片
C.向盛有FeSO4溶液和AgNO3溶液的两支试管分别加入铜片
D.向盛有稀硫酸的两支试管中,分别加人铁片和铜片,再向盛AgNO3溶液的试管中加入铜片。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com