
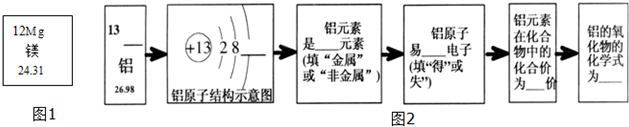
分析 根据在原子中,原子序数=质子数=核外电子数,辨别元素的种类的方法,金属元素在化学反应中容易失去最外层电子等,进行分析解答本题.
解答 解:铝的元素符号为:Al;
根据在原子中,原子序数=质子数=核外电子数=13,2+8+x=13,则x=3,铝的最外层电子数为:3;
根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,可知铝是金属元素;
金属元素在化学反应中容易失去电子,称为阳离子;
铝原子最外层有三个电子,在化学反应中容易失去最外层三个电子,而显+3价;
铝元素的化合价为+3价,氧元素的化合价为-2价,故铝的氧化物的化学式为Al2O3.
故答案为:Al;3;金属;失;+3;Al2O3.
点评 本题考查学生根据在原子中,原子序数=质子数=核外电子数,辨别元素的种类的方法,金属元素在化学反应中容易失去最外层电子进行分析解题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | 10g | B. | 1.5g | C. | 8.5g | D. | 11.5g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2MnO4 KMnO4 | B. | P2O5 Ca3(PO4)2 | C. | NH4Cl HNO3 | D. | Cl2 CaCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫+氧气→二氧化硫 | B. | 氢气+氧气→水 | ||
| C. | 氧化汞→汞+氧气 | D. | 一氧化碳+氧气→二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
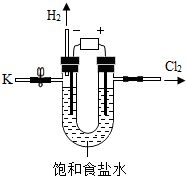 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如右图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如右图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.| 实验步骤 | 实验现象 | 实验结论 |
| 取样,滴加几滴无色酚酞试液 | 溶液变红色 | 待测液呈碱性,表明含有氢氧化钠 |
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com