
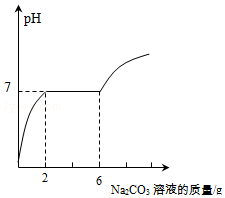
 某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量稀盐酸后,发现忘记了滴加指示剂.因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究:取烧杯中的溶液10g,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液.测得溶液pH与加入的碳酸钠溶液的质量关系如图所示.
某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量稀盐酸后,发现忘记了滴加指示剂.因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究:取烧杯中的溶液10g,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液.测得溶液pH与加入的碳酸钠溶液的质量关系如图所示.分析 (1)根据氢氧化钡和稀盐酸反应生成氯化钡和水;滴入碳酸钠溶液之前烧杯中的液体pH<7,显酸性分析.
(2)滴加碳酸钠溶液的过程中,碳酸钠优先与盐酸反应,之后与氯化钡反应,所以当碳酸钠溶液质量加到2g时,溶液中盐酸恰好处理完,溶液呈中性,当碳酸钠溶液质量加到6g时,氯化钡和碳酸钠恰好完全反应,根据消耗碳酸钠的质量结合化学方程式进行相关计算.
解答 解:(1)氢氧化钡和稀盐酸反应生成氯化钡和水;由图可知,滴入碳酸钠溶液之前烧杯中的液体pH<7,溶液显酸性,说明氢氧化钡溶液和盐酸反应时,盐酸过量,所以滴入碳酸钠溶液之前烧杯中的溶质为.
(2)与氯化钡反应消耗碳酸钠溶液质量=(6g-2g)×13.25%=0.53g
设原烧杯溶液中BaCl2的质量为x,
BaCl2+Na2CO3═BaCO3↓+2NaCl
208 106
x 0.53g
$\frac{208}{x}=\frac{106}{0.53g}$
x=1.04g
原烧杯溶液中氯化钡的质量分数=$\frac{1.04g}{10g}$×100%=10.4%
答案:
(1)氯化钡和氯化氢;
(2)原烧杯溶液中氯化钡的质量分数为10.4%.
点评 本题考查了酸碱中和反应以及实验设计的能力.设计实验时,可以从反应后的产物和其有关的性质着手.


 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:初中化学 来源: 题型:选择题
| A. | 单质中只含有一种元素,因此,只含有一种元素的物质一定是单质 | |
| B. | 碱性溶液的pH大于7,因此,pH大于7的溶液一定是碱性溶液 | |
| C. | 稀有气体原子的最外层电子数为8(氦除外),因此,最外层电子数为8的微粒一定是稀有气体原子 | |
| D. | 中和反应有盐和水生成,因此,有盐和水生成的反应一定是中和反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验 装置 |  硫在氧气中燃烧 |  测定空气中氧气含量 |  铁丝在氧气中燃烧 |  探究燃烧的条件 探究燃烧的条件 |
| 主要作用 | 集气瓶中的水: 吸收反应放出的 热量 | 量筒中的水: 通过水体积的变化得出空气中O2体积分数 | 集气瓶中的水: 冷却溅落的熔融物,防止集气瓶炸裂 | 烧杯中的水: 加热铜片温度, 隔绝空气 |
| 选项 | A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
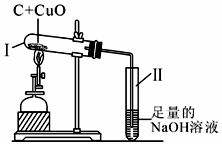 一定量的碳与氧化铜混合加热,反应前后测定装置I、Ⅱ的质量如下.
一定量的碳与氧化铜混合加热,反应前后测定装置I、Ⅱ的质量如下.| 反应前质量(g) | 反应后质量(g) | |
| 装置I | 56.3 | 55.2 |
| 装置Ⅱ | 242.9 | 243.7 |
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
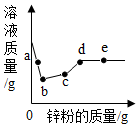 向一定量硝酸银、硝酸铜和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如图.下列说法正确的是( )
向一定量硝酸银、硝酸铜和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如图.下列说法正确的是( )| A. | a点时,溶液中溶质为硝酸锌、硝酸铜、硝酸亚铁 | |
| B. | b点时,所得固体只有银 | |
| C. | c点时,溶液中一定有硝酸锌、硝酸亚铁,可能有硝酸铜 | |
| D. | d点和e点所得固体均为银、铜、铁、锌 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钙、烧碱、Ca(OH)2 | B. | 氢氧化钠、苛性钠、NaOH | ||
| C. | 碳酸钙、熟石灰、CaCO3 | D. | 氧化钙、消石灰、CaO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com