在天平两端托盘上各放一个盛有20g19.6%的稀硫酸的烧杯,并使天平平衡,然后在其中一个烧杯中加入10gFe,另一个烧杯中放入锌,要使反应后天平仍保持平衡,所放入锌的质量是( )
A.5.6g
B.6.5g
C.10g
D.13g
【答案】
分析:根据铁与硫酸反应的方程式中铁与硫酸的质量比,分析完全反应的量,根据完全反应的量及题干中的含义,首先由化学方程式计算出其中一只烧杯中放入10g铁后,增加的质量是多少;然后计算另一只烧杯中加入多少锌片后发生反应所增加的质量必须和前面的相同才可以平衡.
解答:解:由Fe+H
2SO
4=FeSO
4+H
2↑的方程可知,铁与硫酸反应的质量比为56:2=28:1,由题意可知,铁与硫酸的质量比为:10g:(20g×19.6%)=10:3.92,由此可知,硫酸的量不足,硫酸完全反应.
设20g19.6%的稀硫酸与铁反应生成的氢气的质量为X
Fe+H
2SO
4=FeSO
4+H
2↑
98 2
20g×19.6% X
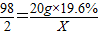
解得X=0.08g
托盘天平中一只烧杯中放入铁后质量增加了:10g-0.08g=9.92g
要使托盘天平仍保持平衡,则另一端烧杯中放入锌片后完全反应后增加的质量必须也是9.92g,
设20g19.6%的稀硫酸反应掉的锌的质量为y
Zn+H
2SO
4=ZnSO
4+H
2↑
65 98
y 20g×19.6%

解得:y=2.6g
由于20g19.6%的稀硫酸反应掉的锌的质量为2.6g,加入锌的质量一定是大于9.92g.所以,硫酸完全反应.由于硫酸都是完全反应,放出的氢气的质量相等.所以,另一个烧杯中放入锌,要使反应后天平仍保持平衡,所放入锌的质量是10g.由以上计算可知:
A、所放入锌的质量是5.6g.不符合题意;
B、所放入锌的质量是6.5g.不符合题意;
C、所放入锌的质量是10g.符合题意;
D、所放入锌的质量是13g.不符合题意.
故选C.
点评:在本题中由于加入的酸是不足量的,与金属反应生成的氢气相等,只要是两边加入金属的质量相等,天平就平衡.

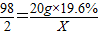 解得X=0.08g
解得X=0.08g 解得:y=2.6g
解得:y=2.6g

 初中暑期衔接系列答案
初中暑期衔接系列答案